名校
1 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图实验。
I.实验探究
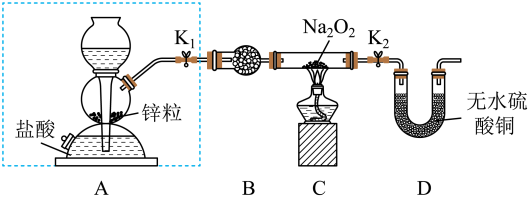
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的H2流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:_________ 。
(2)B装置中所盛放的试剂是_______ ,其作用是________ 。
(3)步骤3中的“必要操作”为打开K1、K2,________ (请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为________ 。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C装置中的硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如图: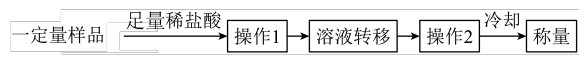
①操作2是________ 。
②在转移溶液时,若溶液转移不完全,测得的Na2O2质量分数_______ (填“偏大”“偏小”或“不变”)。
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的H2流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:
(2)B装置中所盛放的试剂是
(3)步骤3中的“必要操作”为打开K1、K2,
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C装置中的硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如图:

①操作2是
②在转移溶液时,若溶液转移不完全,测得的Na2O2质量分数
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
2 . 三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3。
PCl3、POCl3的部分性质如下:
某兴趣小组模拟该工艺设计实验装置如图(某些夹持装置、加热装置已略去):

(1)仪器a的名称为____ ,B装置中长颈漏斗的作用是___ 。
(2)为使实验顺利进行,还需补充的装置为____ 。
(3)反应时,需严格控制三个条件:
①先制取___ ,缓慢地通入C中,直至C中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是___ 。
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为___ (写化学式)。
(4)反应结束后通过下面步骤测定POCl3产品中Cl的含量,元素Cl的质量分数为____ (写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
[已知:Ag3PO4溶于酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
PCl3、POCl3的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其它 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |

(1)仪器a的名称为
(2)为使实验顺利进行,还需补充的装置为
(3)反应时,需严格控制三个条件:
①先制取
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为
(4)反应结束后通过下面步骤测定POCl3产品中Cl的含量,元素Cl的质量分数为
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
[已知:Ag3PO4溶于酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
您最近一年使用:0次
3 . 某实验小组欲测定煤或石油中的含碳量,称取ag样品进行充分燃烧,测定所得气体(CO2、SO2、N2和O2)中CO2的含量。实验装置如图所示(所用试剂均过量)。
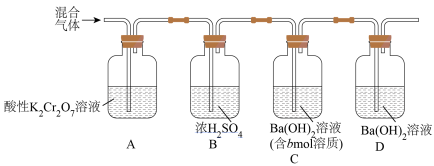
(1)混合气体通过装置A的目的是_______________________ 。
(2)装置D的作用是________________________ 。
(3)实验结束后,还需要向装置中通入N2,其目的是_______________________ 。
(4)将装置C中生成的沉淀过滤,再用xmol/L的盐酸与剩余的Ba(OH)2溶液反应,消耗ymL盐酸,则ag样品中碳元素的质量分数为____________ (列出计算式即可)。

(1)混合气体通过装置A的目的是
(2)装置D的作用是
(3)实验结束后,还需要向装置中通入N2,其目的是
(4)将装置C中生成的沉淀过滤,再用xmol/L的盐酸与剩余的Ba(OH)2溶液反应,消耗ymL盐酸,则ag样品中碳元素的质量分数为
您最近一年使用:0次
名校
4 . 砷(As)广泛分布于自然界,其原子结构示意图是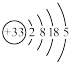
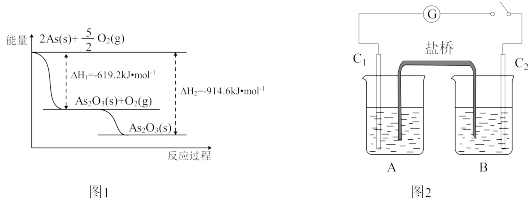
(1)砷位于元素周期表中________ 族,其气态氢化物的稳定性比NH3________ (填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式:________
(3)砷酸盐可发生如下反应:AsO +2I﹣+2H+⇌AsO
+2I﹣+2H+⇌AsO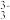 +I2+H2O.图2装置中,C1、C2是石墨电极.A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是
+I2+H2O.图2装置中,C1、C2是石墨电极.A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 ________
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样mg溶于NaOH溶液,得到含AsO 和AsO
和AsO 的混合溶液.As2O5与NaOH溶液反应的离子方程式是
的混合溶液.As2O5与NaOH溶液反应的离子方程式是________ .
②上述混合液用0.02500mol•L﹣1的I2溶液滴定,用________ 做指示剂,滴定至________ ,停止滴定,记录数据.重复滴定2次,平均消耗I2溶液20.00mL.则试样中As2O3的质量分数是________
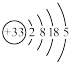
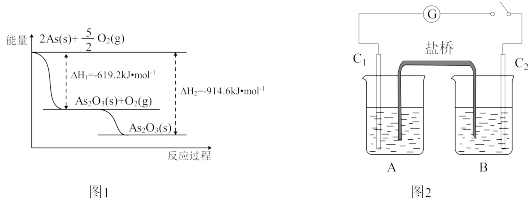
(1)砷位于元素周期表中
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式:
(3)砷酸盐可发生如下反应:AsO
 +2I﹣+2H+⇌AsO
+2I﹣+2H+⇌AsO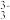 +I2+H2O.图2装置中,C1、C2是石墨电极.A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是
+I2+H2O.图2装置中,C1、C2是石墨电极.A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 (4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样mg溶于NaOH溶液,得到含AsO
 和AsO
和AsO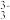 的混合溶液.As2O5与NaOH溶液反应的离子方程式是
的混合溶液.As2O5与NaOH溶液反应的离子方程式是②上述混合液用0.02500mol•L﹣1的I2溶液滴定,用
您最近一年使用:0次
5 . 二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸。一种新型实验室制备方法的装置如图所示:

分液漏斗及2号气瓶中盛放浓度为150g·L-1的NaClO2溶液,1号气瓶中盛放6mol·L-1的H2SO4溶液,3号、4号、5号、6号气瓶中盛放冰水。回答下列问题:
(1)配制500mLNaClO2溶液,需NaClO2固体___ g。
(2)按图连接好各仪器,___ ,加注相应试剂,并抽真空。
(3)打开分液漏斗活塞,让NaClO2溶液缓慢滴入1号气瓶,生成ClO2和一种气体单质。该反应的化学方程式为___ 。
(4)2号气瓶可吸收1号气瓶中产生的气体单质并继续产生ClO2,发生反应的离子方程式为___ ,检验还原产物离子的试剂是___ 。
(5)此制备方法不需要设置尾气处理装置,原因是___ 。
(6)制取完毕后,利用滴定法测定所得溶液中ClO2浓度,滴定20.00mLClO2溶液消耗0.1000mol·L-1Na2S2O3溶液25.00mL,则ClO2含量为___ g·L-1。

分液漏斗及2号气瓶中盛放浓度为150g·L-1的NaClO2溶液,1号气瓶中盛放6mol·L-1的H2SO4溶液,3号、4号、5号、6号气瓶中盛放冰水。回答下列问题:
(1)配制500mLNaClO2溶液,需NaClO2固体
(2)按图连接好各仪器,
(3)打开分液漏斗活塞,让NaClO2溶液缓慢滴入1号气瓶,生成ClO2和一种气体单质。该反应的化学方程式为
(4)2号气瓶可吸收1号气瓶中产生的气体单质并继续产生ClO2,发生反应的离子方程式为
(5)此制备方法不需要设置尾气处理装置,原因是
(6)制取完毕后,利用滴定法测定所得溶液中ClO2浓度,滴定20.00mLClO2溶液消耗0.1000mol·L-1Na2S2O3溶液25.00mL,则ClO2含量为
您最近一年使用:0次
6 . 柴油汽车排放的主要污染物为氮氧化物(NOx)和颗粒物(PM2.5)。
(1)NOx的处理与监测。
①汽车尾气中的NO、NO2和CO可在催化剂存在下反应并转化为参与大气循环的气体,写出NO与CO反应的化学方程式:__ 。
②根据下列反应,计算①所写反应的反应热△H=_ kJ/mol。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol-1
C(g)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2C(g)+O2(g)=2CO(g) △H=-221kJ•mol-1
③监测空气中的氮氧化物(假设为NO2),采集50.00mL含有NO2的空气,加入适量酸化的H2O2的溶液中,使NO2完全被氧化为NO ,则发生反应的化学方程式为
,则发生反应的化学方程式为__ ,除去所得溶液中过量的过氧化氢后,将其稀释至100.0mL,取出20.00mL.稀释后的溶液,向其中加入足量的稀硫酸和铜粉,使所有NO 还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为
还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为__ mg/L。
(2)氮氧化物(NOx)主要用SCR技术(选择性催化还原)处理,SCR技术是使用32%尿素[CO(NH2)]2作为NH3的载体,发生的反应如下:
Ⅰ.[CO(NH2)2]+H2O→2NH3+CO2
Ⅱ.4NH3+4NO+O2→4N2+6H2O
Ⅲ.4NH3+2NO+2NO2→4N2+6H2O
Ⅳ.8NH3+6NO2→7N2+12H2O
Ⅴ.8NH3+6NO2→7N2+12H2O(过量的氨气可通过反应V转化为氮气)。
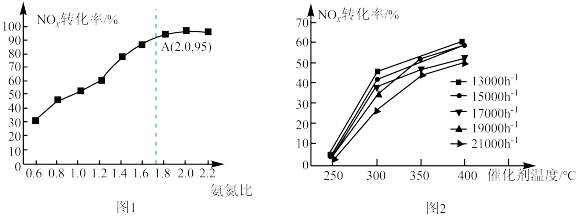
①一定温度下NOx转化率随着氨氮比(NH3与NOx体积比)的变化如图1。当氨氮比为1时,不同空速(单位时间里通过催化剂的空气的量)下NOx转化率随催化剂温度的变化规律如图2。由图2可知催化剂最低活性温度为__ ;图中250℃~300℃时,空速升高,NOx转化率呈下降的趋势,分析其中的原因可能为___ (写出一条)。
②理论喷射尿素水溶液的质量流量的计算式为Qurea= ×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为__ (保留三位有效数字)g·s-1。
(1)NOx的处理与监测。
①汽车尾气中的NO、NO2和CO可在催化剂存在下反应并转化为参与大气循环的气体,写出NO与CO反应的化学方程式:
②根据下列反应,计算①所写反应的反应热△H=
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol-1
C(g)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2C(g)+O2(g)=2CO(g) △H=-221kJ•mol-1
③监测空气中的氮氧化物(假设为NO2),采集50.00mL含有NO2的空气,加入适量酸化的H2O2的溶液中,使NO2完全被氧化为NO
 ,则发生反应的化学方程式为
,则发生反应的化学方程式为 还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为
还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为(2)氮氧化物(NOx)主要用SCR技术(选择性催化还原)处理,SCR技术是使用32%尿素[CO(NH2)]2作为NH3的载体,发生的反应如下:
Ⅰ.[CO(NH2)2]+H2O→2NH3+CO2
Ⅱ.4NH3+4NO+O2→4N2+6H2O
Ⅲ.4NH3+2NO+2NO2→4N2+6H2O
Ⅳ.8NH3+6NO2→7N2+12H2O
Ⅴ.8NH3+6NO2→7N2+12H2O(过量的氨气可通过反应V转化为氮气)。
①一定温度下NOx转化率随着氨氮比(NH3与NOx体积比)的变化如图1。当氨氮比为1时,不同空速(单位时间里通过催化剂的空气的量)下NOx转化率随催化剂温度的变化规律如图2。由图2可知催化剂最低活性温度为

②理论喷射尿素水溶液的质量流量的计算式为Qurea=
 ×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
您最近一年使用:0次
7 . 氯的许多化合物是高效广谱的消毒剂,同时又是生产中重要的化工原料。回答下列问题:
(1)NaClO溶液能够杀灭新冠病毒的原因是__ ,为了较长时间保持NaClO溶液的杀菌能力,NaClO溶液应密闭避光保存的原因是__ 。
(2)ClO2是一种广谱杀菌剂,能用于水的消毒。甲醇还原法具有一次性投资少、操作工艺简单、生产效率高运行成本低和产品纯净等优点,得到了广泛的推广和应用,成为目前CO的主要工业化生产方法。请配平其主反应式[其中n(Na2SO4):n(NaHSO4)=1:1];__ NaClO3+__ CH3OH+__ H2SO4=__ ClO2↑+6HCOOH+__ Na2SO4+__ NaHSO4+__ +CO2↑。
(3)ClO2也可以亚氯酸钠和稀盐酸为原料制备,该过程中氧化剂与还原剂的物质的量之比为__ ;在上述过程中会发生副反应:NaClO2+4HCl=NaCl+2Cl2↑+2H2O,研究表明,产生的Cl2的含量随盐酸溶液的浓度有如图变化关系,推测其原因是__ 。

(4)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为__ kg(保留整数)。
(1)NaClO溶液能够杀灭新冠病毒的原因是
(2)ClO2是一种广谱杀菌剂,能用于水的消毒。甲醇还原法具有一次性投资少、操作工艺简单、生产效率高运行成本低和产品纯净等优点,得到了广泛的推广和应用,成为目前CO的主要工业化生产方法。请配平其主反应式[其中n(Na2SO4):n(NaHSO4)=1:1];
(3)ClO2也可以亚氯酸钠和稀盐酸为原料制备,该过程中氧化剂与还原剂的物质的量之比为

(4)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为
您最近一年使用:0次
名校
8 . 无水四氯化锡(SnCl4)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如下装置制备四氯化锡(部分夹持装置已略去)。

有关信息如下表:
回答下列问题:
(1)对比分液漏斗,装置甲中恒压滴液漏斗的优点是___________________________ 。
仪器A中发生反应的离子方程式为_______________________________________ 。
(2)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________ (填现象)后,开始加热丁装置。锡熔化后适当增大氯气流量并继续加热丁装置。继续加热丁装置的目的是促进氯气与锡反应和_________________________________ 。
(3)如果缺少乙装置可能产生的后果是_______________________________________ 。
(4)戊装置中球形冷凝管的冷水进口为______ (填“a”或“b”)。
(5)己装置中碱石灰的作用是_______________________________________________ 。
(6)碘氧化法滴定分析产品中Sn(II)的含量。准确称取m g产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液做指示剂,用c mol·L–1碘标准溶液滴定。滴入最后一滴标准溶液,出现__________ 时达到滴定终点,此时消耗碘标准溶液V mL,则产品中Sn(II)的质量分数为____________ (用字母表示)。

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | −33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,Sn(II)易被氧化为Sn(IV) | 无色液体,易水解 |
回答下列问题:
(1)对比分液漏斗,装置甲中恒压滴液漏斗的优点是
仪器A中发生反应的离子方程式为
(2)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到
(3)如果缺少乙装置可能产生的后果是
(4)戊装置中球形冷凝管的冷水进口为
(5)己装置中碱石灰的作用是
(6)碘氧化法滴定分析产品中Sn(II)的含量。准确称取m g产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液做指示剂,用c mol·L–1碘标准溶液滴定。滴入最后一滴标准溶液,出现
您最近一年使用:0次
2020-09-11更新
|
299次组卷
|
2卷引用:安徽省马鞍山市2020届高三毕业班第三次教学质量监测(三模)理科综合化学试题
名校
9 . 为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分的含量,某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。下列说法中正确的是


| A.②和③中应依次盛装碱石灰和无水CaCl2 |
| B.若将①装置换成盛有NaOH溶液的洗气瓶,则测得的NaCl含量偏小 |
| C.实验时应先点燃酒精灯,再关闭b、打开a,一段时间后测定②和③的质量变化 |
D.若测得②和③的增重分别为m2和m3,则混合物中Na2CO3·10H2O的质量为28.6×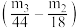 |
您最近一年使用:0次
2020-11-27更新
|
1150次组卷
|
3卷引用:浙江省宁波市效实中学2020-2021学年高一上学期期中考试化学试题
浙江省宁波市效实中学2020-2021学年高一上学期期中考试化学试题河南省遂平县第一高级中学2023-2024学年高一上学期第一次月考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
名校
10 . 某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用cmol•L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
下列关于样品组成分析的说法,正确的是
下列关于样品组成分析的说法,正确的是
| A.根据题给数据不能求出样品中所含H2C2O4•2H2O的质量分数 |
B.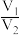 越大,样品中H2C2O4•2H2O含量一定越高 越大,样品中H2C2O4•2H2O含量一定越高 |
C.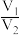 =3时,样品中一定不含杂质 =3时,样品中一定不含杂质 |
| D.若所用KMnO4溶液实际浓度偏高,则测得样品中Fe元素含量偏高 |
您最近一年使用:0次



