柴油汽车排放的主要污染物为氮氧化物(NOx)和颗粒物(PM2.5)。
(1)NOx的处理与监测。
①汽车尾气中的NO、NO2和CO可在催化剂存在下反应并转化为参与大气循环的气体,写出NO与CO反应的化学方程式:__ 。
②根据下列反应,计算①所写反应的反应热△H=_ kJ/mol。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol-1
C(g)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2C(g)+O2(g)=2CO(g) △H=-221kJ•mol-1
③监测空气中的氮氧化物(假设为NO2),采集50.00mL含有NO2的空气,加入适量酸化的H2O2的溶液中,使NO2完全被氧化为NO ,则发生反应的化学方程式为
,则发生反应的化学方程式为__ ,除去所得溶液中过量的过氧化氢后,将其稀释至100.0mL,取出20.00mL.稀释后的溶液,向其中加入足量的稀硫酸和铜粉,使所有NO 还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为
还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为__ mg/L。
(2)氮氧化物(NOx)主要用SCR技术(选择性催化还原)处理,SCR技术是使用32%尿素[CO(NH2)]2作为NH3的载体,发生的反应如下:
Ⅰ.[CO(NH2)2]+H2O→2NH3+CO2
Ⅱ.4NH3+4NO+O2→4N2+6H2O
Ⅲ.4NH3+2NO+2NO2→4N2+6H2O
Ⅳ.8NH3+6NO2→7N2+12H2O
Ⅴ.8NH3+6NO2→7N2+12H2O(过量的氨气可通过反应V转化为氮气)。
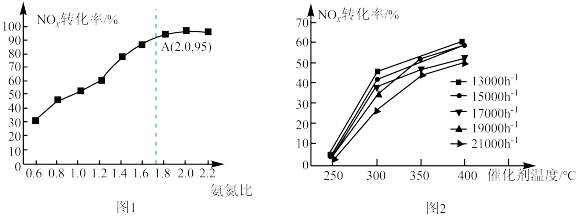
①一定温度下NOx转化率随着氨氮比(NH3与NOx体积比)的变化如图1。当氨氮比为1时,不同空速(单位时间里通过催化剂的空气的量)下NOx转化率随催化剂温度的变化规律如图2。由图2可知催化剂最低活性温度为__ ;图中250℃~300℃时,空速升高,NOx转化率呈下降的趋势,分析其中的原因可能为___ (写出一条)。
②理论喷射尿素水溶液的质量流量的计算式为Qurea= ×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为__ (保留三位有效数字)g·s-1。
(1)NOx的处理与监测。
①汽车尾气中的NO、NO2和CO可在催化剂存在下反应并转化为参与大气循环的气体,写出NO与CO反应的化学方程式:
②根据下列反应,计算①所写反应的反应热△H=
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol-1
C(g)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2C(g)+O2(g)=2CO(g) △H=-221kJ•mol-1
③监测空气中的氮氧化物(假设为NO2),采集50.00mL含有NO2的空气,加入适量酸化的H2O2的溶液中,使NO2完全被氧化为NO
 ,则发生反应的化学方程式为
,则发生反应的化学方程式为 还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为
还原为NO,消耗的铜粉的质量为1.92mg,则原空气中的NO2含量为(2)氮氧化物(NOx)主要用SCR技术(选择性催化还原)处理,SCR技术是使用32%尿素[CO(NH2)]2作为NH3的载体,发生的反应如下:
Ⅰ.[CO(NH2)2]+H2O→2NH3+CO2
Ⅱ.4NH3+4NO+O2→4N2+6H2O
Ⅲ.4NH3+2NO+2NO2→4N2+6H2O
Ⅳ.8NH3+6NO2→7N2+12H2O
Ⅴ.8NH3+6NO2→7N2+12H2O(过量的氨气可通过反应V转化为氮气)。
①一定温度下NOx转化率随着氨氮比(NH3与NOx体积比)的变化如图1。当氨氮比为1时,不同空速(单位时间里通过催化剂的空气的量)下NOx转化率随催化剂温度的变化规律如图2。由图2可知催化剂最低活性温度为

②理论喷射尿素水溶液的质量流量的计算式为Qurea=
 ×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
×Qmass×CNOx。其中,Qurea为尿素水溶液喷射的质量流量;RAN为NH3与NOx的化学计量数之比;Murea为尿素分子的摩尔质量;ωmass为尿素水溶液的质量分数;Mmass为排气的摩尔质量;Qmass为排气的质量流量;CNOx为排气中NOx的体积分数。已知在空转15000h-1下,排出气体的平均摩尔质量约为32g/mol,其中NO的体积分数约为0.2%,排气的质量流量约为9.2g·s-1,按题意选择优化条件,以反应Ⅳ为例计算理论喷射尿素水溶液的质量流量为
更新时间:2020-11-03 11:23:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少大气污染有重要意义。回答下列问题:
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用 还原NO的反应原理为:
还原NO的反应原理为:
 。该反应的能量变化过程如图:
。该反应的能量变化过程如图:
___________  (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在___________ (填“高温”、“低温”或“任意温度”)条件下有利于自发进行。
Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成 ,可有效降低汽车尾气污染。
,可有效降低汽车尾气污染。
已知反应:
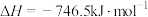 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
___________  (填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________ (填标号)。
a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的___________ 点方向移动。
(4)E点的压强平衡常数
___________  (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:___________ (填“Cat-1”或“Cat-2”)。
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是___________ 。
I.汽车尾气中的NO对人体健康有严重危害,一种新技术用
 还原NO的反应原理为:
还原NO的反应原理为:
 。该反应的能量变化过程如图:
。该反应的能量变化过程如图: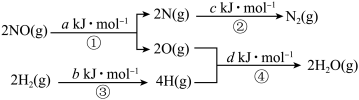

 (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在Ⅱ.汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成
 ,可有效降低汽车尾气污染。
,可有效降低汽车尾气污染。已知反应:

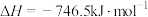 。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示:
。在密闭容器中充入10molCO和8molNO发生反应,平衡时NO的体积分数与温度、压强的关系如图所示: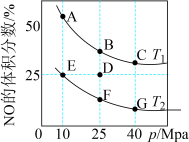

 (填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是
(填“>”、“<”或“=”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是a.压缩容器体积 b.升高温度 c.恒压充入氦气 d.加入催化剂
(3)反应在D点达到平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的
(4)E点的压强平衡常数

 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×该组分物质的量分数)。(5)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1:1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
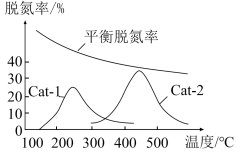
②催化剂Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】运用化学反应原理研究合成氨反应有重要意义,已知在 时
时 的
的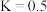 。请完成下列探究。
。请完成下列探究。
(1) 时,在
时,在 的反应容器中进行合成氨反应,一段时间后,测得
的反应容器中进行合成氨反应,一段时间后,测得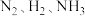 的物质的量分别为
的物质的量分别为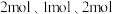 ,则此时反应
,则此时反应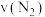 正
正_____ 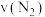 逆(填“>”、“<”、“=”或“不能确定”)。
逆(填“>”、“<”、“=”或“不能确定”)。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡_______ 移动(填“向左”、“向右”或“不”)。
(3)下列关于工业合成氨的说法正确的是_______。
(4)氨氧化法是工业生产中制取硝酸的主要途径。
已知: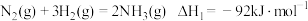
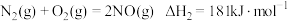

写出氨气催化氧化生成 和水蒸气的热化学方程式
和水蒸气的热化学方程式_______ 。
 时
时 的
的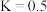 。请完成下列探究。
。请完成下列探究。(1)
 时,在
时,在 的反应容器中进行合成氨反应,一段时间后,测得
的反应容器中进行合成氨反应,一段时间后,测得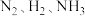 的物质的量分别为
的物质的量分别为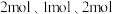 ,则此时反应
,则此时反应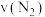 正
正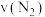 逆(填“>”、“<”、“=”或“不能确定”)。
逆(填“>”、“<”、“=”或“不能确定”)。(2)若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
(3)下列关于工业合成氨的说法正确的是_______。
A.因为 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的平衡转化率 |
| D.使用催化剂不仅可以加快反应速率还可以降低反应所需的活化能 |
已知:
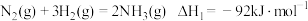
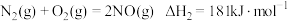

写出氨气催化氧化生成
 和水蒸气的热化学方程式
和水蒸气的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4— (绿色)、Cr2O72— (橙红色)、CrO42— (黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_____ 。
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应__________ 。
②由图可知,溶液酸性增大,CrO42-的平衡转化率____ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____ 。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__ 0(填“大于”“小于”或“等于”)。
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,CrO42-的平衡转化率
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】铁及碳的化合物在社会生产、生活中有着广泛的应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s) 3Fe(s)+4CO(g) △H=+646.0kJ•mol﹣1
3Fe(s)+4CO(g) △H=+646.0kJ•mol﹣1
②C(s)+CO2(g)⇌2CO(g) △H=+172.5kJ•mol﹣1
则Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)△H=
3Fe(s)+4CO2(g)△H=___ 。
(2)反应Fe(s)+CO2(g) FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是___ (填“放热”或“吸热”)反应。
②温度为973K时,在某恒容密闭容器中发生上述反应。下列有关说法能说明该反应已达到平衡状态的是___ (填字母)。
A.c(CO2)=c(CO)
B.v正(CO2)=v逆(CO)
C.体系压强不变
D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g) CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=___ mol•L﹣1•s﹣1。
②图1中t2时刻改变的条件是___ (任写两种,下同);图2中t2时刻改变的条件是___ 。

(1)磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s)
 3Fe(s)+4CO(g) △H=+646.0kJ•mol﹣1
3Fe(s)+4CO(g) △H=+646.0kJ•mol﹣1②C(s)+CO2(g)⇌2CO(g) △H=+172.5kJ•mol﹣1
则Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g)△H=
3Fe(s)+4CO2(g)△H=(2)反应Fe(s)+CO2(g)
 FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是
②温度为973K时,在某恒容密闭容器中发生上述反应。下列有关说法能说明该反应已达到平衡状态的是
A.c(CO2)=c(CO)
B.v正(CO2)=v逆(CO)
C.体系压强不变
D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)
 CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=
②图1中t2时刻改变的条件是

您最近一年使用:0次
【推荐2】I.氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。已知:
①N2(g)+3H2(g) 2NH3(g)△H1=-92.4 kJ/mol
2NH3(g)△H1=-92.4 kJ/mol
②C(s)+O2(g) CO2(g)△H2=-393.8 kJ/mol
CO2(g)△H2=-393.8 kJ/mol
③N2(g)+3H2(g)+C(s)+O2(g) H2NCOONH4(s)△H3=-645.7 kJ/mol
H2NCOONH4(s)△H3=-645.7 kJ/mol
回答下列问题:
(1)写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:_______ 。
(2)某温度下,达到平衡后,欲增加NH3的平衡浓度,可采取的措施有_______(填标号)。
II.当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4 L的恒容密闭容器中,充入1.2 mol CO2和2.4 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。回答下列问题:
CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。回答下列问题:
(3)下列能用来判断该反应达到平衡状态的标志是_______(填标号)。
(4)3 min后,反应达到平衡状态,此时测得反应后的H2的转化率为45%。c(CO2)=_______ mol/L;v(H2O)=_______ mol/(L∙min)。
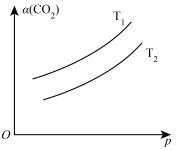
(5)在一定条件下,体系中的CO2的平衡转化率( )与温度(T)和压强(p)的关系如图所示。则T1
)与温度(T)和压强(p)的关系如图所示。则T1_______ T2(填“>”或“<”),判断的理由是_______ 。
①N2(g)+3H2(g)
 2NH3(g)△H1=-92.4 kJ/mol
2NH3(g)△H1=-92.4 kJ/mol②C(s)+O2(g)
 CO2(g)△H2=-393.8 kJ/mol
CO2(g)△H2=-393.8 kJ/mol③N2(g)+3H2(g)+C(s)+O2(g)
 H2NCOONH4(s)△H3=-645.7 kJ/mol
H2NCOONH4(s)△H3=-645.7 kJ/mol回答下列问题:
(1)写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:
(2)某温度下,达到平衡后,欲增加NH3的平衡浓度,可采取的措施有_______(填标号)。
| A.加H2NCOONH4 | B.加催化剂 | C.减小体积增大压强 | D.移走CO2 |
II.当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4 L的恒容密闭容器中,充入1.2 mol CO2和2.4 mol H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。回答下列问题:
CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。回答下列问题:(3)下列能用来判断该反应达到平衡状态的标志是_______(填标号)。
| A.混合气体的密度不再随时间改变 |
| B.c(CH3OH)不再随时间改变 |
| C.混合气体的平均相对分子质量不再随时间改变 |
| D.混合气体的质量不再随时间改变 |
(5)在一定条件下,体系中的CO2的平衡转化率(
 )与温度(T)和压强(p)的关系如图所示。则T1
)与温度(T)和压强(p)的关系如图所示。则T1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.4kJ·mol-1
S(l)+2CO2(g) △H1=-37.4kJ·mol-1
b.S(l)+2H2O(g) 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______ 。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g) CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
①前10min内的平均反应速率v(CO)=______ ;在20min时,温度T2下,该反应的化学平衡常数为_______ 。
②若30min时升高温度,化学平衡常数值_______ (填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______ (填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g) CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的_____ (填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g) 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。

则k1=____ ,m=_____ ,n=_____ 。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1=-37.4kJ·mol-1
S(l)+2CO2(g) △H1=-37.4kJ·mol-1b.S(l)+2H2O(g)
 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1则CO和水蒸气完全反应生成H2和CO2的热化学方程式为
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)
 CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:| 反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
| 0min | 2 | 4 | 0 |
| 10min | 2 | ||
| 20min | 0.2 |
①前10min内的平均反应速率v(CO)=
②若30min时升高温度,化学平衡常数值
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有
④在恒温恒容下,下列可以判断CO(g)+2H2(g)
 CH3OH(g)反应达到平衡状态的
CH3OH(g)反应达到平衡状态的a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)
 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
则k1=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:________________________ 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为______ (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为______________________________________________ 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是______________________ 。
(4)滤液2中,c(Co2+) :c(Ni2+)=_________________ 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为________ 。(用含a、b、c的式子表达,无需化简)

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是
(4)滤液2中,c(Co2+) :c(Ni2+)=
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 是极具发展潜力的新型锂离子电池电极材料,一种制备
是极具发展潜力的新型锂离子电池电极材料,一种制备 的方法为:
的方法为: 。图是以废铁屑和
。图是以废铁屑和 为原料制备
为原料制备 的流程。
的流程。

请回答下列问题:
(1)制备过程中,废铁屑要先用热的纯碱溶液洗涤,其目的是_______ 。
(2)操作Ⅰ为趁热过滤,操作Ⅱ的步骤是_______ 、过滤。
(3)制备 时必须在惰性气体氛围中进行,其原因是
时必须在惰性气体氛围中进行,其原因是_______ 。
(4)取 产品经灼烧、稀硫酸溶解、
产品经灼烧、稀硫酸溶解、 还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用
还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用 的酸性
的酸性 标准溶液滴定,经3次滴定,每次消耗
标准溶液滴定,经3次滴定,每次消耗 溶液的体积如表:
溶液的体积如表:
①写出用 还原的离子方程式
还原的离子方程式_______ 。
②造成第一次测定结果的原因可能是_______ (写一条)。
③到达滴定终点时现象为_______ ;根据滴定结果,可计算产品中 的质量分数为
的质量分数为_______ 。
 是极具发展潜力的新型锂离子电池电极材料,一种制备
是极具发展潜力的新型锂离子电池电极材料,一种制备 的方法为:
的方法为: 。图是以废铁屑和
。图是以废铁屑和 为原料制备
为原料制备 的流程。
的流程。
请回答下列问题:
(1)制备过程中,废铁屑要先用热的纯碱溶液洗涤,其目的是
(2)操作Ⅰ为趁热过滤,操作Ⅱ的步骤是
(3)制备
 时必须在惰性气体氛围中进行,其原因是
时必须在惰性气体氛围中进行,其原因是(4)取
 产品经灼烧、稀硫酸溶解、
产品经灼烧、稀硫酸溶解、 还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用
还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用 的酸性
的酸性 标准溶液滴定,经3次滴定,每次消耗
标准溶液滴定,经3次滴定,每次消耗 溶液的体积如表:
溶液的体积如表:| 实验序号 | 1 | 2 | 3 |
消耗 溶液体积 溶液体积 | 21.38mL | 19.98mL | 20.02mL |
①写出用
 还原的离子方程式
还原的离子方程式②造成第一次测定结果的原因可能是
③到达滴定终点时现象为
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:请回答:

(1)写出样品加热分解的反应方程式_________ ;
(2)装置B中冰水的作用是__________ ;
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是_________ 。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气

(1)写出样品加热分解的反应方程式
(2)装置B中冰水的作用是
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
您最近一年使用:0次



