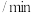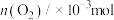1 . 以 制备甲醇是实现“双碳”目标的重要途径。
制备甲醇是实现“双碳”目标的重要途径。
(1) 加氢制甲醇的能量变化如图所示,该反应的热化学方程式为
加氢制甲醇的能量变化如图所示,该反应的热化学方程式为___________ 。 和
和 ,180℃下反应生成甲醇和水:
,180℃下反应生成甲醇和水: 。测得各物质物质的量随时间的部分变化图像如图所示:
。测得各物质物质的量随时间的部分变化图像如图所示: 的平均反应速率为
的平均反应速率为___________  。
。
②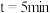 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
③下列能够说明总反应已达到化学平衡状态的是___________ (填标号)。
A.容器中气体密度不再改变 B.容器内总压强不再改变
C. 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变
④其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为___________ 。
(3)将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。实验测得 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)处电极入口通甲醇,正极的电极反应式为___________ 。 ℃时,等物质的量的
℃时,等物质的量的 和
和 充入体积为1L的恒容密闭容器中发生反应:
充入体积为1L的恒容密闭容器中发生反应: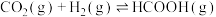
 。实验测得反应速率为:
。实验测得反应速率为: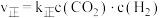 ,
,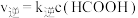 ,
, 、
、 为速率常数。
为速率常数。
① ℃时,
℃时,
___________  (填具体数值)。
(填具体数值)。
②温度从 ℃到
℃到 ℃时,
℃时, ,则
,则 ℃时的平衡压强
℃时的平衡压强___________ (填“>”“<”“=”) ℃时的平衡压强。
℃时的平衡压强。
 制备甲醇是实现“双碳”目标的重要途径。
制备甲醇是实现“双碳”目标的重要途径。(1)
 加氢制甲醇的能量变化如图所示,该反应的热化学方程式为
加氢制甲醇的能量变化如图所示,该反应的热化学方程式为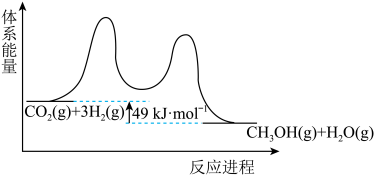
 和
和 ,180℃下反应生成甲醇和水:
,180℃下反应生成甲醇和水: 。测得各物质物质的量随时间的部分变化图像如图所示:
。测得各物质物质的量随时间的部分变化图像如图所示: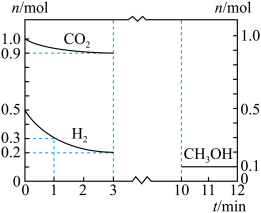
 的平均反应速率为
的平均反应速率为 。
。②
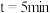 时,正反应速率
时,正反应速率③下列能够说明总反应已达到化学平衡状态的是
A.容器中气体密度不再改变 B.容器内总压强不再改变
C.
 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变④其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得
 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为(3)将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。实验测得
 向B电极定向移动,则
向B电极定向移动,则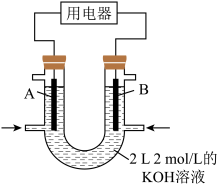
 ℃时,等物质的量的
℃时,等物质的量的 和
和 充入体积为1L的恒容密闭容器中发生反应:
充入体积为1L的恒容密闭容器中发生反应: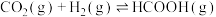
 。实验测得反应速率为:
。实验测得反应速率为: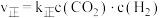 ,
,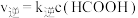 ,
, 、
、 为速率常数。
为速率常数。①
 ℃时,
℃时,
 (填具体数值)。
(填具体数值)。②温度从
 ℃到
℃到 ℃时,
℃时, ,则
,则 ℃时的平衡压强
℃时的平衡压强 ℃时的平衡压强。
℃时的平衡压强。
您最近半年使用:0次
2 .  表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.1L0.1mol/L的 溶液中含有的氢离子数为 溶液中含有的氢离子数为 |
B.常温下,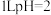 的 的 溶液中含 溶液中含 的数目为 的数目为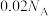 |
C.由  ,若反应放出46.1kJ的热量,则生成 ,若反应放出46.1kJ的热量,则生成 个 个 |
D.氢氧燃料电池装置中,当有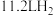 参加反应时,转移的电子数为 参加反应时,转移的电子数为 |
您最近半年使用:0次
3 . 为尽快实现“碳达峰”“碳中和”,碳化学研究已成为当前科学研究的热点。由CO2合成淀粉的部分流程如图所示:
①
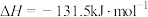
②
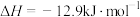
③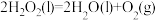
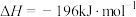
④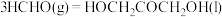
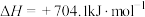
回答下列问题:
(1)反应①中,反应物的总能量_______ (填“大于”、“小于”或“等于”,下同)生成物的总能量,反应④中,反应物的总键能_______ 生成物的总键能。
(2)反应①中使用催化剂的作用有_______ (填标号);
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界_______ (填“吸收”或“放出”)的热量为______ kJ。(所有能量均充分利用,且不考㤐能量的损耗)
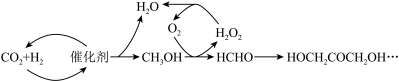
①

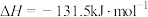
②

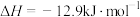
③
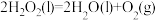
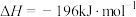
④
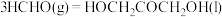
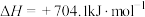
回答下列问题:
(1)反应①中,反应物的总能量
(2)反应①中使用催化剂的作用有
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界
您最近半年使用:0次
名校
4 . 在新型催化剂 作用下,
作用下, 氧化
氧化 可获得Cl2:
可获得Cl2: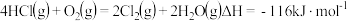 。关于反应
。关于反应 ,下列说法正确的是
,下列说法正确的是
 作用下,
作用下, 氧化
氧化 可获得Cl2:
可获得Cl2: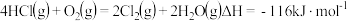 。关于反应
。关于反应 ,下列说法正确的是
,下列说法正确的是A.反应活化能: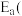 正 正 逆 逆 |
B.每生成标准状况下22.4L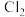 ,放出 ,放出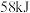 的热量 的热量 |
C.使用高效催化剂,可使平衡时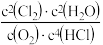 的值增大 的值增大 |
D.断裂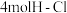 键的同时,有 键的同时,有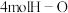 键生成,说明该反应达到平衡状态 键生成,说明该反应达到平衡状态 |
您最近半年使用:0次
名校
5 . T℃,在2L密闭容器中投入一定量A、B,发生反应:3A(g)+bB(g) cC(g)
cC(g)  H=-QkJ•mol-1(Q>0)。12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
H=-QkJ•mol-1(Q>0)。12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
 cC(g)
cC(g)  H=-QkJ•mol-1(Q>0)。12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
H=-QkJ•mol-1(Q>0)。12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是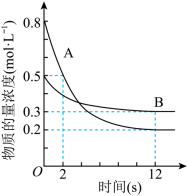
| A.前12s内,A的平均反应速率为0.025mol•L-1•s-1 |
| B.化学计量数之比b:c=1:4 |
| C.2s内,A的转化率为37.5% |
| D.12s内,A和B反应放出的热量为0.2QkJ |
您最近半年使用:0次
名校
解题方法
6 . I下列物品或设施:①陶瓷餐具②砖瓦③混凝土桥墩④门窗玻璃⑤水晶镜片⑥石英钟⑦水晶项链⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片
(1)①含有硅单质的是___________ ②含有硅酸盐的是___________
Ⅱ在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无臭气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。___________ 。
(3)写出反应①的化学方程式___________ ,当反应消耗0.15mol物质D时,转移电子的数目为___________ 。
Ⅲ某空间站的生命保障系统功能之一是实现氧循环,该保障系统中涉及到反应:CO2(g)+4H2(g) CH4(g)+2H2O(g),回答下列问题:
CH4(g)+2H2O(g),回答下列问题:
(4)以上反应过程中能量变化情况如图所示。CO2的电子式为___________ ,生成18gH2O(g)时,向环境___________ (选填释放,吸收)能量为___________ kJ。
(1)①含有硅单质的是
Ⅱ在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无臭气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。

(3)写出反应①的化学方程式
Ⅲ某空间站的生命保障系统功能之一是实现氧循环,该保障系统中涉及到反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g),回答下列问题:
CH4(g)+2H2O(g),回答下列问题:(4)以上反应过程中能量变化情况如图所示。CO2的电子式为
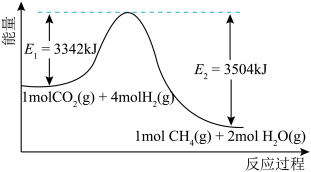
您最近半年使用:0次
2024-04-15更新
|
158次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高一下学期3月月考试题 化学试题
7 . t℃时,在恒温、恒容的密闭容器中发生反应: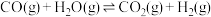
 (a>0)
(a>0)
实验数据如下。
下列说法不正确的是
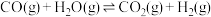
 (a>0)
(a>0)实验数据如下。
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的能量变化/kJ | |||
| CO |  |  |  | ||
| ① | 1 | 4 | 0 | 0 | 0.8a |
| ② | 1 | 1 | 2 | 2 | b |
A.①中 的平衡转化率为20% 的平衡转化率为20% |
| B.t℃时,该反应的平衡常数为1 |
C.当②中CO和 浓度相等时,反应达到平衡 浓度相等时,反应达到平衡 |
| D.达到平衡时②中能量变化:b=1.5a |
您最近半年使用:0次
解题方法
8 . 强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢可构成火箭推进剂.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知:0.4mol液态肼与足量的液态过氧化氢反应生成N2和水蒸气时放出256.0kJ的热量。
(1)该反应的热化学方程式为________________ ;
(2)则16g液态肼与液态过氧化氢反应生成气态水时放出的热量是________________ kJ;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________ 。
(1)该反应的热化学方程式为
(2)则16g液态肼与液态过氧化氢反应生成气态水时放出的热量是
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近半年使用:0次
9 . 一定温度下,在2.0L密闭容器中加入纳米级 并通入
并通入 ,发生反应:
,发生反应: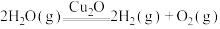
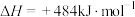 ,不同时间产生
,不同时间产生 的物质的量见下表,下列说法错误的是
的物质的量见下表,下列说法错误的是
 并通入
并通入 ,发生反应:
,发生反应: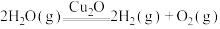
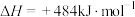 ,不同时间产生
,不同时间产生 的物质的量见下表,下列说法错误的是
的物质的量见下表,下列说法错误的是时间 | 20 | 40 | 60 | 80 |
| 1.0 | 1.6 | 2.0 | 2.0 |
A.使用纳米级 ,可以增大平衡时氧气的体积分数 ,可以增大平衡时氧气的体积分数 |
B.达到平衡时,至少需要从外界吸收能量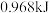 |
C.增大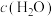 ,可以改变反应的限度 ,可以改变反应的限度 |
D.前20min的平均反应速率 |
您最近半年使用:0次
10 . 回答下列问题。
(1)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量:___________ 。
(2)已知1 mol C(s,石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:___________ 。
(3)1.7g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ热量:___________ 。
(4)25℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ热量:___________ 。
(5)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,请写出1mol NH3分解对应的热化学方程式:
2NH3(g) ΔH=-92 kJ·mol-1,请写出1mol NH3分解对应的热化学方程式:___________ 。
(1)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量:
(2)已知1 mol C(s,石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:
(3)1.7g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ热量:
(4)25℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ热量:
(5)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92 kJ·mol-1,请写出1mol NH3分解对应的热化学方程式:
2NH3(g) ΔH=-92 kJ·mol-1,请写出1mol NH3分解对应的热化学方程式:
您最近半年使用:0次