名校
1 . Co2O3、Co3+是均属于极强的氧化剂,在生产中有着重要的应用。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO ,写出该反应的离子方程式
,写出该反应的离子方程式___ 。设计实验证明反应后溶液中含有SO :
:___ 。(已知:S2O 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)
(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3 Co3+
Co3+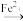 Co2+、MnO
Co2+、MnO
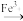 Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___ (写出计算过程)。
(1)一定条件下,Co3+与足量Na2S2O3溶液反应后生成Co2+和SO
 ,写出该反应的离子方程式
,写出该反应的离子方程式 :
: 与H+反应生成S、SO2,BaS2O3不溶于水)
与H+反应生成S、SO2,BaS2O3不溶于水)(2)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co2O3
 Co3+
Co3+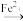 Co2+、MnO
Co2+、MnO
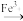 Mn2+
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
您最近一年使用:0次
解题方法
2 . 以Fe2O3/CeO2作催化剂,可用乙烯脱除烟气中SO2并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的CO2,实验装置(夹持装置已略)如图所示:
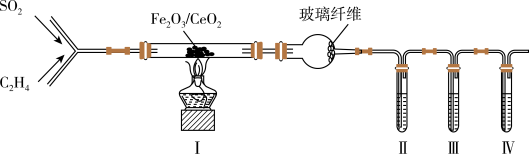
已知:反应原理为:CH2=CH2+3SO2 3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
(1)装置中玻璃纤维的作用是___ 。
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是___ (填序号)。
①酸性KMnO4溶液②澄清石灰水③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10mol·L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数___ 。(写出计算过程)

已知:反应原理为:CH2=CH2+3SO2
 3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。(1)装置中玻璃纤维的作用是
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是
①酸性KMnO4溶液②澄清石灰水③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10mol·L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数
您最近一年使用:0次
2021-06-23更新
|
581次组卷
|
2卷引用:江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题
名校
解题方法
3 .  是一种空气污染物,会导致硫酸型酸雨。下列选项所述措施均能减少工业排放尾气中
是一种空气污染物,会导致硫酸型酸雨。下列选项所述措施均能减少工业排放尾气中 含量的是
含量的是
①以其他清洁能源代替燃煤②对煤炭进行固硫、脱硫处理③用“石灰乳+氧气”吸收含 的尾气④将含
的尾气④将含 的尾气向高空排放
的尾气向高空排放
 是一种空气污染物,会导致硫酸型酸雨。下列选项所述措施均能减少工业排放尾气中
是一种空气污染物,会导致硫酸型酸雨。下列选项所述措施均能减少工业排放尾气中 含量的是
含量的是①以其他清洁能源代替燃煤②对煤炭进行固硫、脱硫处理③用“石灰乳+氧气”吸收含
 的尾气④将含
的尾气④将含 的尾气向高空排放
的尾气向高空排放| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
您最近一年使用:0次
2022-12-23更新
|
488次组卷
|
5卷引用:江苏省扬州市邗江中学2022-2023学年高一上学期12月月考化学试题
江苏省扬州市邗江中学2022-2023学年高一上学期12月月考化学试题江苏省宿迁市泗阳县实验高级中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)上海市实验学校2022-2023学年高一上学期期末考试化学试题(已下线)题型49 臭氧和过氧化氢 环境保护
4 . 现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的分子式为___ 。
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A与氢气加成生成2—甲基戊烷,则A的可能结构有___ 种,(不考虑立体异构)。
②B能使溴水和酸性高锰酸钾褪色,1H—NMR谱(核磁共振氢谱)中只有一个信号,则B的结构简式为___ ,其命名为:___ 。
③C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:___ 。
(1)该化合物的分子式为
(2)已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
①A与氢气加成生成2—甲基戊烷,则A的可能结构有
②B能使溴水和酸性高锰酸钾褪色,1H—NMR谱(核磁共振氢谱)中只有一个信号,则B的结构简式为
③C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:
您最近一年使用:0次
名校
解题方法
5 . 为加快锌粒与1 mol·L-1H2SO4溶液反应产生氢气的速率,下列措施可行的是
| A.改用2 mol·L-1HNO3溶液 | B.改用质量分数为98%的H2SO4 |
| C.滴加少量CuSO4溶液 | D.加少量醋酸钠固体 |
您最近一年使用:0次
2021-06-21更新
|
156次组卷
|
2卷引用:江苏省镇江实验高级中学2020-2021学年高一下学期期中化学试题
名校
6 . 炼铁厂以赤铁矿石(主要成分为Fe2O3)、焦炭、石灰石、空气等为主要原料炼铁,主要反应过程如图所示:

请根据所学知识回答相关问题:
(1)炼铁厂用来炼铁的主要设备是___ ,原料中焦炭的作用有___ 。反应③的化学方程式为___ 。
(2)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
I.将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为___ 。
II.测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中Cr2O 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将___ (填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)___ 。

请根据所学知识回答相关问题:
(1)炼铁厂用来炼铁的主要设备是
(2)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
I.将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为
II.测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中Cr2O
 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
7 . 在恒温恒容条件下发生可逆反应N2(g)+3H2(g) 2NH3(g)。下列说法正确的是
2NH3(g)。下列说法正确的是
 2NH3(g)。下列说法正确的是
2NH3(g)。下列说法正确的是| A.平衡时一定存在c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| B.平衡时氨气的百分含量不再变化 |
| C.平衡时断开1个N≡N键的同时有6个N—H键生成 |
| D.平衡时1molN2和3molH2反应能完全反应生成2molNH3 |
您最近一年使用:0次
名校
解题方法
8 . 二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g) CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0
在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO(g)+CH3OCH3(g)
 CH3COOCH3(g)△H1<0
CH3COOCH3(g)△H1<0反应Ⅱ:CH3COOCH3(g)+2H2(g)
 CH3CH2OH(g)+CH3OH(g)△H2<0
CH3CH2OH(g)+CH3OH(g)△H2<0在固定 CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ, 平衡时各物质的物质的量分数随温度的变化如图所示。下列说法正确的是

| A.曲线 B 表示 H2的物质的量分数随温度的变化 |
| B.600 K 后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移 |
| C.测得 X 点 CH3CH2OH 的物质的量分数是 10%,则 X 点反应Ⅱ有:v 正>v 逆 |
| D.其他条件不变,延长反应时间能提高平衡混合物中乙醇含量 |
您最近一年使用:0次
2023-04-15更新
|
334次组卷
|
5卷引用:江苏省连云港市赣榆区2022-2023学年高二下学期4月期中考试化学试题
名校
9 . 碱式氯化铜[Cu2(OH)2Cl2·3H2O]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
(1)模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
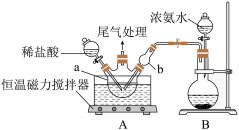
①实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是___________ (填名称);
②反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是:溶液中___________ 、干燥管b中___________ 。
③滴加过程中需要严格控制盐酸的用量的原因___________ 。
④碱式氧化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得。该反应的化学方程式为___________ 。
(2)采用沉淀滴定法测定某无水碱式氯化铜[Cux(OH)xClz]中的氯元素含量。称取产品6.435 g,加稀硝酸溶解,并加水定容至250 mL,得到待测液。请补充完整测定氯的实验过程:准确量取25.00 mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加足量0.010 mol/L AgNO3溶液,至静置后向上层清液中继续滴加0.010 mol/LAgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1 mL,___________ ,重复上述实验2~3次。[须使用的实验试剂:0.010 mol/LNH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
已知:①Ag++SCN-=AgSCN↓ (白色沉淀);
②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。
(1)模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

①实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是
②反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是:溶液中
③滴加过程中需要严格控制盐酸的用量的原因
④碱式氧化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得。该反应的化学方程式为
(2)采用沉淀滴定法测定某无水碱式氯化铜[Cux(OH)xClz]中的氯元素含量。称取产品6.435 g,加稀硝酸溶解,并加水定容至250 mL,得到待测液。请补充完整测定氯的实验过程:准确量取25.00 mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加足量0.010 mol/L AgNO3溶液,至静置后向上层清液中继续滴加0.010 mol/LAgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1 mL,
已知:①Ag++SCN-=AgSCN↓ (白色沉淀);
②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。
您最近一年使用:0次
名校
10 . 废弃的锂离子电池中含有多种金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是某小组研究从柠檬酸浸出液中分离出铜并制备碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]的制备流程。

(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为_______ 。
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(II)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为:_______ 。
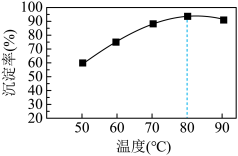
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是_______ 。
(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。
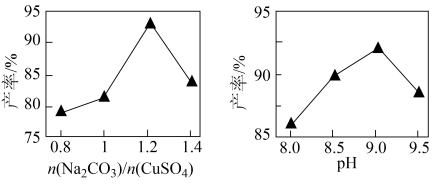
①补充完整由0.5mol/L CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30mL0.5mol/LNa2CO3溶液,将烧杯置于70℃的水浴中,_______ ,低温烘干,得到碱式碳酸铜。(实验中可选用的试剂或仪器:0.1mol/LBaCl2溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是_______ 。
③称取9.55g碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。则该产品的化学式为_______ 。

(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(II)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为:
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是

(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。

①补充完整由0.5mol/L CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30mL0.5mol/LNa2CO3溶液,将烧杯置于70℃的水浴中,
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是
③称取9.55g碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。则该产品的化学式为
您最近一年使用:0次
2023-03-27更新
|
605次组卷
|
2卷引用:江苏省海安高级中学2022-2023学年高三下学期3月月考化学试题



