废弃的锂离子电池中含有多种金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是某小组研究从柠檬酸浸出液中分离出铜并制备碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]的制备流程。

(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为_______ 。
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(II)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为:_______ 。
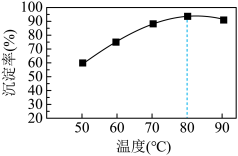
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是_______ 。
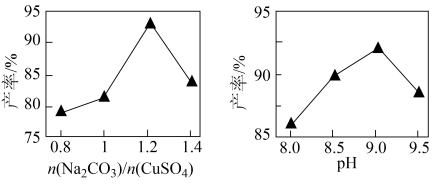
(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。
①补充完整由0.5mol/L CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30mL0.5mol/LNa2CO3溶液,将烧杯置于70℃的水浴中,_______ ,低温烘干,得到碱式碳酸铜。(实验中可选用的试剂或仪器:0.1mol/LBaCl2溶液、0.1mol/LNaOH溶液、0.1mol/L盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是_______ 。
③称取9.55g碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。则该产品的化学式为_______ 。

(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效的将Cu(II)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为:
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80℃时达到最高点,后略有下降,下降可能的原因是

(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。

①补充完整由0.5mol/L CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30mL0.5mol/LNa2CO3溶液,将烧杯置于70℃的水浴中,
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是
③称取9.55g碱式碳酸铜[xCuCO3∙yCu(OH)2∙zH2O]产品,通入氢气充分加热反应后,得到4.8g固体残留物,同时生成2.2g二氧化碳和2.7g水。则该产品的化学式为
更新时间:2023-03-27 17:20:16
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室以(NH4)2CO3和Cu(OH)2为原料制备高纯Cu2(OH)2CO3的方法如下:___________ (答两点)。
(2)“蒸氨”在如图所示的实验装置中进行。___________ 。
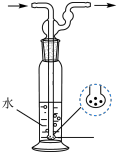
②实验采用三个盛有水的洗气瓶吸收尾气的目的为___________ ;与上图所示洗气瓶相比,采用三个如图所示装置的优点为___________ 。___________ 。
(3)已知:①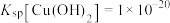 ;
;
②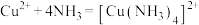
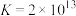 ;
;
③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,___________ ,低温烘干。(须使用的试剂:浓氨水、1mol∙L-1 NaOH溶液、0.1mol∙L-1 BaCl2溶液、蒸馏水)
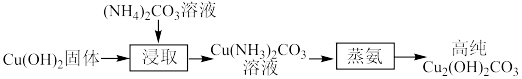
(2)“蒸氨”在如图所示的实验装置中进行。

②实验采用三个盛有水的洗气瓶吸收尾气的目的为
(3)已知:①
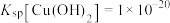 ;
;②
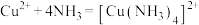
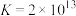 ;
;③沉淀速率过快时,Cu(OH)2絮状沉淀易裹挟杂质。
以CuSO4∙5H2O固体为原料,补充完整制备纯净Cu(OH)2的实验方案:取一定质量的CuSO4∙5H2O固体分批加入蒸馏水中,搅拌至完全溶解,
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1)下图为铁及其化合物的“价-类”二维图。
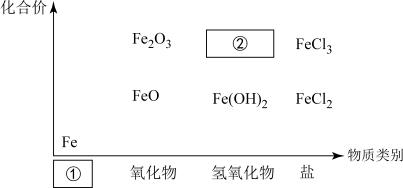
填写二维图缺失的类别 ①___________ 和化学式②___________ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质类别 上看,FeCl3属于___________ ,可能与___________ 发生反应(填序号);从化合价角度看,Fe3+具有___________ 性,可能与___________ 发生反应(填序号)。
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于___________ (填“纯净物”或“混合物”),请写出Cu(OH)2·2CuCO3与盐酸反应的化学方程式 ___________
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于___________ 酸;NaH2PO2为___________ 盐(填序号)
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式___________ 。
(1)下图为铁及其化合物的“价-类”二维图。

填写二维图缺失的
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】铜器在空气中久置会和空气中的水蒸气、CO2、O2作用产生绿锈,该绿锈俗称铜绿,又称孔雀石[主要成分为Cu2(OH)2CO3],铜绿能与酸反应生成铜盐、CO2和H2O。某同学实现了铜→铜绿→M 的转化。
的转化。
回答下列问题:
(1)Cu2(OH)2CO3中Cu元素的化合价为_______ 。
(2)“铜→铜绿”的化学方程式为_______ 。
(3)若“铜绿→M”时,加入足量的稀硫酸,紧接着“M→Cu(OH)2”时,加入足量的Ba(OH)2,经过上述操作,_______ (填“能”或“不能”)得到纯净的Cu(OH)2,理由为_______ 。
(4)“M→Cu(OH)2”的过程中,过滤时主要用到的玻璃仪器有_______ 。“P→Cu”的反应过程中观察到的现象为_______ 。
(5)取m g铜绿投入足量的稀硫酸中,产生的CO2的质量为_______ g。
 的转化。
的转化。回答下列问题:
(1)Cu2(OH)2CO3中Cu元素的化合价为
(2)“铜→铜绿”的化学方程式为
(3)若“铜绿→M”时,加入足量的稀硫酸,紧接着“M→Cu(OH)2”时,加入足量的Ba(OH)2,经过上述操作,
(4)“M→Cu(OH)2”的过程中,过滤时主要用到的玻璃仪器有
(5)取m g铜绿投入足量的稀硫酸中,产生的CO2的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】硫酰氯(SO2Cl2)是重要的化工试剂,常作氯化剂或氯磺化剂。也可用于制作药品、染料、表面活性剂等。有关物质的性质如下表:
在实验室利用SO2和Cl2在活性炭催化作用下制取SO2Cl2,装置如图所示。



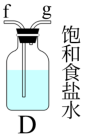
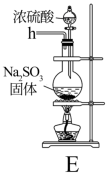
(1)实验时,A装置中发生的离子方程式___________ 。
(2)B装置中冷凝管进水口是___________ 。(填“m”或“n”),B中干燥管盛有的物质是___________ 。
(3)欲制取少量SO2Cl2,选择图中的装置(可以重复选用),其连接顺序为:a、___________ 、h。
(4)去除C装置会降低SO2和Cl2的利用率,可能的原因是___________ 。
(5)已知SO2Cl2遇水强烈水解生成两种强酸。向SO2Cl2溶于水所得溶液中逐滴加入AgNO3溶液,最先生成的沉淀是_____ 。[已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2SO4)=1.2×10-5]
(6)少量硫酰氯也可由氯磺酸(ClSO3H)分解获得,该反应的化学方程式为2ClSO3H=H2SO4+SO2Cl2从分解的产物中分离初硫酰氯的操作方法是___________ 。
(7)当通入装置B中的氯气为1.12L(已转化为标准状况),最后通过蒸馏得到纯净的硫酰氯5.4g,则磺酰氯的产率为___________ 。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有___________ (填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈瓶发烫,可适当降温 ④加热三颈瓶
| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
| SO2Cl2 | -54.1 | 69.1 | 易水解 |
| H2SO4 | 10.4 | 338 |





(1)实验时,A装置中发生的离子方程式
(2)B装置中冷凝管进水口是
(3)欲制取少量SO2Cl2,选择图中的装置(可以重复选用),其连接顺序为:a、
(4)去除C装置会降低SO2和Cl2的利用率,可能的原因是
(5)已知SO2Cl2遇水强烈水解生成两种强酸。向SO2Cl2溶于水所得溶液中逐滴加入AgNO3溶液,最先生成的沉淀是
(6)少量硫酰氯也可由氯磺酸(ClSO3H)分解获得,该反应的化学方程式为2ClSO3H=H2SO4+SO2Cl2从分解的产物中分离初硫酰氯的操作方法是
(7)当通入装置B中的氯气为1.12L(已转化为标准状况),最后通过蒸馏得到纯净的硫酰氯5.4g,则磺酰氯的产率为
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈瓶发烫,可适当降温 ④加热三颈瓶
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】聚合氯化铝晶体是介于AlCl3和Al(OH)3 之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:___________ (用化学式表示)。
(2)升高pH至4.0~5.0的目的是___________ 。
(3)生产过程中可循环使用的物质是___________ (用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___________ (填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有___________ 。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为___________ (填试剂名称),C操作为___________ (填操作名称)
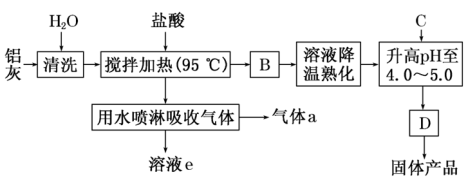
(2)升高pH至4.0~5.0的目的是
(3)生产过程中可循环使用的物质是
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[Al2(OH)nCl6-n·xH2O]m,
①称取a g晶体,制成粉末,加热至质量不再变化为止,称量为b g。此过程可能用到的下列仪器有
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体,进行如下操作:用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为c g。A试剂为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铂和钯同属于铂族元素,其价格均高于黄金,在工业上有广泛的应用。电解精炼铜阳极泥中除含有较多的铂、钯和银以外,还有少量的镍、铜等元素。一种综合提取阳极泥中贵重金属的工艺流程如下:
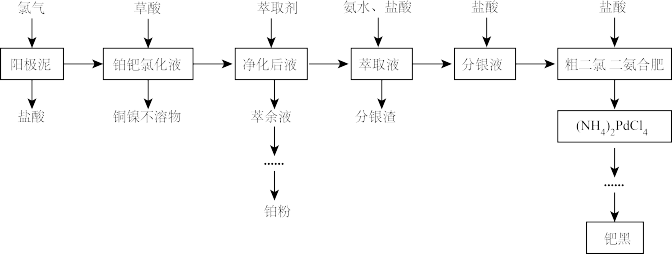
请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是_______ 。
(2)阳极泥中的单质钯反应后转化为 请写出该反应的离子方程式
请写出该反应的离子方程式_______ 。
(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
表2反应温度对铜镍去除率的影响
则草酸的过量系数应为_______ 。实际工业中采用的温度为80—85℃。试分析其原因_______ 。
(4)已知 配离子存在解离平衡:
配离子存在解离平衡: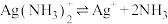 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理_______ 。
(5)分银液中加盐酸把 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为_______ 。
(6)海绵钯具有优良的吸氢功能,其密度为 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=_______  ,氢气的浓度r=
,氢气的浓度r=_______ (吸附容量R是指1g钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)。
吸附氢气的物质的量)。

请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是
(2)阳极泥中的单质钯反应后转化为
 请写出该反应的离子方程式
请写出该反应的离子方程式(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
| 过量系数 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 1.0 | 16.93 | 1.47 | 68.44 | 46.15 |
| 1.5 | 4.67 | 0.61 | 91.30 | 77.66 |
| 2.0 | 0.091 | 0.031 | 99.83 | 98.86 |
| 2.5 | 0.25 | 0.042 | 99.53 | 98.46 |
| 3.0 | 0.28 | 0.040 | 99.48 | 98.53 |
| 4.0 | 0.26 | 0.035 | 99.52 | 98.72 |
| 温度 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 70 | 0.65 | 0.130 | 98.799 | 95.24 |
| 75 | 0.26 | 0.091 | 9.52 | 96.67 |
| 80 | 0.18 | 0.043 | 99.66 | 98.42 |
| 85 | 0.15 | 0.045 | 99.72 | 98.35 |
| 90 | 0.14 | 0.042 | 99.74 | 98.46 |
| 95 | 0.14 | 0.040 | 99.74 | 98.53 |
(4)已知
 配离子存在解离平衡:
配离子存在解离平衡: ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理(5)分银液中加盐酸把
 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为(6)海绵钯具有优良的吸氢功能,其密度为
 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=
,氢气的浓度r= 吸附氢气的物质的量)。
吸附氢气的物质的量)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。某实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体的胃液中(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
实验Ⅰ.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是___________ 。
(2)试剂1是___________ ,试剂2是___________ 。
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有少量___________ ,上述实验中能说明溶液①中含有Fe2+的实验现象为___________ 。
(4)写出浅红色溶液②加H2O2溶液后变为深红色溶液③的离子方程式___________ 。
(5)小王同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。小王同学猜测的依据是___________ 。
实验Ⅱ.测定该补铁剂中铁元素的含量。
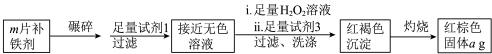
(6)若每片补铁剂为bg,则补铁剂中铁元素的百分含量为___________ 。(用含m、a、b的代数式表示)
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体的胃液中(含盐酸)。
Ⅱ.KSCN中的硫元素为-2价。
实验Ⅰ.检验该补铁剂中铁元素的价态。

(1)将补铁剂碾碎的目的是
(2)试剂1是
(3)加入试剂2后溶液变为浅红色,说明溶液①中含有少量
(4)写出浅红色溶液②加H2O2溶液后变为深红色溶液③的离子方程式
(5)小王同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。小王同学猜测的依据是
实验Ⅱ.测定该补铁剂中铁元素的含量。

(6)若每片补铁剂为bg,则补铁剂中铁元素的百分含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
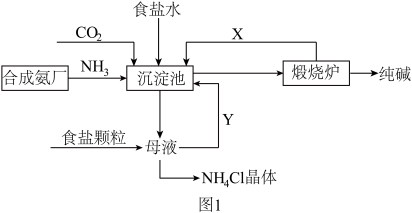
【推荐2】我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如图 1:
(1)完成有关反应的化学方程式
①沉淀池:_______
②煅烧炉_______
(2)联合制碱法的优点表述中,错误的是_______。
某实验小组,利用下列装置图 2 模拟“联合制碱法”的第一步反应。

(3)上述装置中接口连接顺序为_______。
(4)D 中应选用的液体为_______ 。
(5)为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含 NaCl、NaHCO3杂质:
i.检验产品纯碱中是否含有 NaCl,可取少量试样溶于水后,再滴加_______ 试剂,确定沉淀已经完全的操作是:_______ 。
ii.滴定法测定纯碱产品中 NaHCO3含量的方法是:准确称取纯碱样品 W g,放入锥形瓶中加蒸馏水溶解,加 1~2 滴酚酞指示剂,用 c mol∙L−1的 HCl 溶液滴定至溶液由红色变为无色(指示 +H+→
+H+→ 反应的终点),所用HCl溶液体积为 V1mL,再加1~2滴甲基橙指示剂,继续用 HCl 溶液滴定至溶液由黄色变为橙色,所用 HCl 溶液总体积为V2mL。则纯碱样品中NaHCO3质量分数为
反应的终点),所用HCl溶液体积为 V1mL,再加1~2滴甲基橙指示剂,继续用 HCl 溶液滴定至溶液由黄色变为橙色,所用 HCl 溶液总体积为V2mL。则纯碱样品中NaHCO3质量分数为_______ 。(用含 V1,V2,c,W 的代数式表示)

(1)完成有关反应的化学方程式
①沉淀池:
②煅烧炉
(2)联合制碱法的优点表述中,错误的是_______。
| A.生产原料为:食盐、NH3、CO2 | B.副产物氯化铵可做氮肥 |
| C.生产过程中可循环利用的物质只有 CO2 | D.原料利用率高 |
某实验小组,利用下列装置图 2 模拟“联合制碱法”的第一步反应。

(3)上述装置中接口连接顺序为_______。
| A.a 接 c;b 接 f、e 接 d | B.a 接d;b 接 f、e 接 c |
| C.b 接 d;a 接 e、f 接 c | D.b 接 c;a 接 f、e 接d |
(5)为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含 NaCl、NaHCO3杂质:
i.检验产品纯碱中是否含有 NaCl,可取少量试样溶于水后,再滴加
ii.滴定法测定纯碱产品中 NaHCO3含量的方法是:准确称取纯碱样品 W g,放入锥形瓶中加蒸馏水溶解,加 1~2 滴酚酞指示剂,用 c mol∙L−1的 HCl 溶液滴定至溶液由红色变为无色(指示
 +H+→
+H+→ 反应的终点),所用HCl溶液体积为 V1mL,再加1~2滴甲基橙指示剂,继续用 HCl 溶液滴定至溶液由黄色变为橙色,所用 HCl 溶液总体积为V2mL。则纯碱样品中NaHCO3质量分数为
反应的终点),所用HCl溶液体积为 V1mL,再加1~2滴甲基橙指示剂,继续用 HCl 溶液滴定至溶液由黄色变为橙色,所用 HCl 溶液总体积为V2mL。则纯碱样品中NaHCO3质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】维生素C(化学式:C6H8O6,相对分子质量:176)属于外源性维生素,人体不能自身合成,必须从食物中摄取。每100 g鲜榨橙汁中含有大约37.5 mg维生素C,实验室可用碘量法测定橙汁中维生素C的含量,发生的化学反应为C6H8O6+I2=C6H6O6+2HI。
某学习小组欲用该方法测定某橙汁饮料中维生素C的含量,实验步骤及相关数据如下。
①标准液的稀释:移取浓度为0.008 000 mol·L-1的碘标准溶液20.00 mL于250 mL容量瓶中,定容,摇匀备用。
②移取10.00 mL饮料样品[密度为1.0 g·(cm-3)]于250 mL锥形瓶中,加入50 mL蒸馏水,2 mL指示剂。
③在滴定管中装入稀释后的标准液滴定至终点,读取并记录相关数据。
④重复测定3次,数据记录如下表。
回答下列问题:
(1)实验中盛装标准溶液应选择___________ (填“酸式”或“碱式”)滴定管。滴定前为何要稀释标准溶液?___________ 。
(2)步骤②中加入的指示剂是___________ ,判断滴定达到终点的现象是___________ 。
(3)计算该饮料样品中维生素C的含量为___________ mg/100 g。由滴定结果判断该饮料___________ (填“是”或“不是”)天然果汁。
某学习小组欲用该方法测定某橙汁饮料中维生素C的含量,实验步骤及相关数据如下。
①标准液的稀释:移取浓度为0.008 000 mol·L-1的碘标准溶液20.00 mL于250 mL容量瓶中,定容,摇匀备用。
②移取10.00 mL饮料样品[密度为1.0 g·(cm-3)]于250 mL锥形瓶中,加入50 mL蒸馏水,2 mL指示剂。
③在滴定管中装入稀释后的标准液滴定至终点,读取并记录相关数据。
④重复测定3次,数据记录如下表。
| 第一次 | 第二次 | 第三次 | |
| 滴定前读数/mL | 0.00 | 0.44 | 1.33 |
| 滴定终点读数/mL | 30.03 | 30.42 | 31.32 |
(1)实验中盛装标准溶液应选择
(2)步骤②中加入的指示剂是
(3)计算该饮料样品中维生素C的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】某废旧金属材料中主要为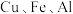 及其氧化物的混合物。利用该废旧金属材料制备胆矾
及其氧化物的混合物。利用该废旧金属材料制备胆矾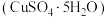 的一种流程如下:
的一种流程如下: 可将
可将 与
与 分离,但不能将
分离,但不能将 与
与 分离。
分离。
回答下列问题:
(1)“破碎”的目的是___________ 。
(2)“碱浸”时发生反应的离子方程式为___________ 。
(3)“酸浸、氧化”的温度不宜过高,原因是___________ ;“滤渣2”的主要成分是___________ (填化学式)。
(4)下列选项中可以检验酸浸、氧化后溶液里是否含有 的是___________。
的是___________。
(5)测定产品的纯度:准确称取胆矾样品 ,完全溶解于稀硫酸中,用过量的
,完全溶解于稀硫酸中,用过量的 溶液沉淀其中的铜元素,得到蓝色沉淀质量为
溶液沉淀其中的铜元素,得到蓝色沉淀质量为 。该样品纯度为
。该样品纯度为___________ (保留3位有效数字)。
 及其氧化物的混合物。利用该废旧金属材料制备胆矾
及其氧化物的混合物。利用该废旧金属材料制备胆矾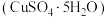 的一种流程如下:
的一种流程如下: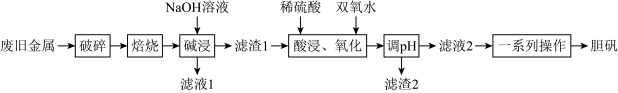
 可将
可将 与
与 分离,但不能将
分离,但不能将 与
与 分离。
分离。回答下列问题:
(1)“破碎”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸、氧化”的温度不宜过高,原因是
(4)下列选项中可以检验酸浸、氧化后溶液里是否含有
 的是___________。
的是___________。A. 溶液,新制氯水 溶液,新制氯水 | B.酸性高锰酸钾溶液 |
C. 溶液 溶液 | D.淀粉 试纸 试纸 |
(5)测定产品的纯度:准确称取胆矾样品
 ,完全溶解于稀硫酸中,用过量的
,完全溶解于稀硫酸中,用过量的 溶液沉淀其中的铜元素,得到蓝色沉淀质量为
溶液沉淀其中的铜元素,得到蓝色沉淀质量为 。该样品纯度为
。该样品纯度为
您最近一年使用:0次
【推荐2】介孔 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
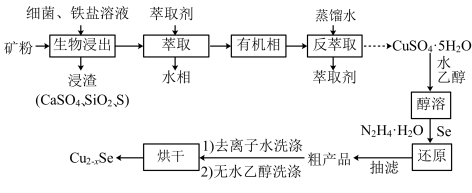
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2)“生物浸出”时, 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为___________ 。此时铁盐___________ (填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。
(3)将“浸渣”溶于 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出___________ (填化学式)。
(4)实验室“萃取”时,用到的主要仪器是___________ ,若萃取剂为苯,“萃取”后得到的“水相”位于___________ (填“上层”或“下层”)。
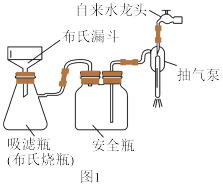
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是___________ 。
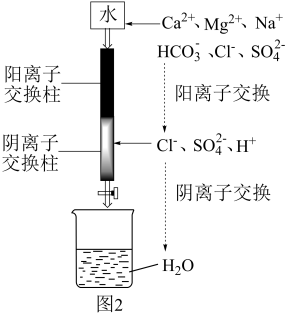
(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为___________ 。
(7)某工厂用10吨该矿石合成介孔 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,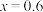 ,则最终可以得到
,则最终可以得到
___________  。
。
 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)“生物浸出”时,
 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为(3)将“浸渣”溶于
 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出(4)实验室“萃取”时,用到的主要仪器是
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是

(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为

(7)某工厂用10吨该矿石合成介孔
 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,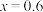 ,则最终可以得到
,则最终可以得到
 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以黄铜矿(主要成分是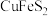 ,含
,含 杂质)为原料制备高纯度铁红和化工产生
杂质)为原料制备高纯度铁红和化工产生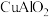 ,流程如下:
,流程如下:
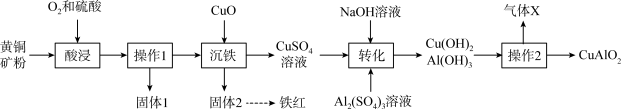
回答下列问题:
(1)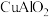 中铜元素的化合价为
中铜元素的化合价为___________ 。“固体1”的主要成分是___________ (填化学式)。
(2)实验室进行操作1需要使用的玻璃仪器有___________ (填名称)。
(3)“酸浸”时 发生反应生成
发生反应生成 、
、 ,离子方程式为
,离子方程式为___________ 。
(4)分离“固体2”时的操作包括过滤、洗涤和干燥,检验洗涤液中不含 的操作是
的操作是___________ 。
(5)“操作2”为高温灼烧,发生反应的化学方程式为___________ 。
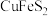 ,含
,含 杂质)为原料制备高纯度铁红和化工产生
杂质)为原料制备高纯度铁红和化工产生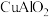 ,流程如下:
,流程如下:
回答下列问题:
(1)
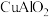 中铜元素的化合价为
中铜元素的化合价为(2)实验室进行操作1需要使用的玻璃仪器有
(3)“酸浸”时
 发生反应生成
发生反应生成 、
、 ,离子方程式为
,离子方程式为(4)分离“固体2”时的操作包括过滤、洗涤和干燥,检验洗涤液中不含
 的操作是
的操作是(5)“操作2”为高温灼烧,发生反应的化学方程式为
您最近一年使用:0次



