1 . 氯化银(AgCl,白色)、铬酸银( ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或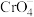 )。下列叙述正确的是
)。下列叙述正确的是
 ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或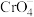 )。下列叙述正确的是
)。下列叙述正确的是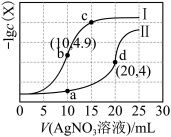
A.T℃下,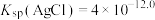 |
B.曲线Ⅱ表示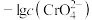 与V( 与V( 溶液)的变化关系 溶液)的变化关系 |
| C.向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 |
D.浓度均为 的 的 和 和 ,可通过分步沉淀进行分离 ,可通过分步沉淀进行分离 |
您最近半年使用:0次
2 . 已知:常温下Ksp(CuS)<Ksp(PbS)。25℃时,饱和溶液中–lgc(S2-)与-lgc(X)的关系如图所示,其中,X代表Cu2+、Pb2+。下列叙述错误的是
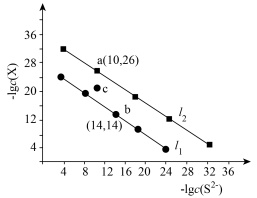
| A.l1直线代表–lgc(S2-)与-lgc(Pb2+)的关系 |
| B.该温度下Ksp(CuS)=1.0×10-36 |
| C.加热,可使溶液由c点变到a点 |
D.PbS(s)+Cu2+(aq) CuS(s)+Pb2+(aq)的平衡常数K=108 CuS(s)+Pb2+(aq)的平衡常数K=108 |
您最近半年使用:0次
解题方法
3 . 下列离子方程式书写正确的是
| A.Na与水反应:Na+2H2O=Na++2OH-+H2↑ |
B.过量NaOH溶液与NH4HCO3溶液反应:HC +OH-=H2O+C +OH-=H2O+C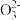 |
| C.FeO溶于稀硝酸:FeO+2H+=Fe2++H2O |
| D.向AgNO3溶液中滴加过量氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
您最近半年使用:0次
4 . 工业上可以从冶炼锌、锌制品加工企业回收的废渣(含有ZnCO3、ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
(1)为提高锌渣与硫酸的反应速率,可以采取的措施有___________ (任写一种)。
(2)向酸浸液中加入的试剂A有多种选择,若A是H2O2,反应的离子方程式是___________ 。
(3)酸浸液用试剂A氧化后,为了使Fe(OH)3、Al(OH)3沉淀完全应控制的pH的范围为___________ ,调整溶液pH可选试剂为___________ 。
A.NaOH B.ZnO C.NH3‧H2O D.Zn(OH)2
(4)试剂B为___________ 。
(5)为检验沉淀丙是否洗涤干净,可以检验最后一次洗涤液中是否含有___________ (填离子符号)予以判断。
(6)上述流程所得ZnO产品中锌的含量远超过锌渣中锌元素的含量,其原因是___________ 。

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 5.4 | 4.0 | 6.5 |
| 完全沉淀 | 3.7 | 9.6 | 6.4 | 5.2 | 8.0 |
(1)为提高锌渣与硫酸的反应速率,可以采取的措施有
(2)向酸浸液中加入的试剂A有多种选择,若A是H2O2,反应的离子方程式是
(3)酸浸液用试剂A氧化后,为了使Fe(OH)3、Al(OH)3沉淀完全应控制的pH的范围为
A.NaOH B.ZnO C.NH3‧H2O D.Zn(OH)2
(4)试剂B为
(5)为检验沉淀丙是否洗涤干净,可以检验最后一次洗涤液中是否含有
(6)上述流程所得ZnO产品中锌的含量远超过锌渣中锌元素的含量,其原因是
您最近半年使用:0次
名校
解题方法
5 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: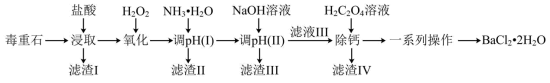
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近半年使用:0次
解题方法
6 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: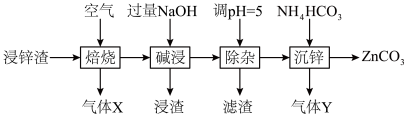
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):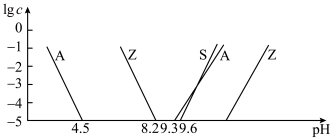
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
名校
7 . 根据下列实验操作和现象得出的结论错误的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硫酸酸化的FeSO4,溶液中滴入H2O2溶液 | 溶液变黄 | 氧化性:H2O2>Fe3+ |
| B | 向CO还原Fe2O3,所得到的产物中加入稀盐酸,再滴加KSCN溶液 | 溶液不变红 | Fe2O3一定已全部被CO还原 |
| C | 向NaCl溶液中滴入几滴AgNO3溶液,再加入氨水,振荡 | 先产生白色沉淀,加氨水后沉淀消失 | AgCl不溶于水,但可溶于氨水 |
| D | 用pH试纸分别测定浓度均为0.1mol·L-1的CH3COONa溶液,NaNO2溶液的pH | 前者pH约为9,后者pH约为8 | Ka(CH3COOH)<Ka(HNO2) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
8 . 某同学分别向0.1 mol/L、5 mol/L NaCl溶液中滴加2滴0.1 mol/L AgNO3溶液,均有白色沉淀,振荡后,前者沉淀不消失、后者沉淀消失。查阅水溶液中银氯配合物的分布曲线(以银的百分含量计),如下图所示,下列说法不正确 的是
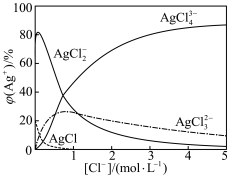
| A.AgCl在不同浓度的NaCl溶液中溶解度不同 |
| B.银氯配合物中Ag+是中心离子,Cl−是配体 |
C.上述实验中,白色沉淀消失的离子方程式是Ag++ 4Cl−=AgCl |
| D.推测浓盐酸中滴加2滴0.1 mol/L AgNO3溶液,产生白色沉淀,振荡后沉淀消失 |
您最近半年使用:0次
名校
解题方法
9 . 下列实验方案、现象、结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向饱和 溶液中加入少量 溶液中加入少量 粉末,过滤,在滤渣中加入盐酸 粉末,过滤,在滤渣中加入盐酸 | 产生气泡,固体部分溶解 |  |
| B | 将某卤代烃与NaOH水溶液共热,充分反应后,向溶液中先加入 ,再加入 ,再加入 | 产生白色沉淀 | 该卤代烃含氯元素 |
| C | 向等浓度等体积的 中分别加入等浓度等体积的 中分别加入等浓度等体积的 溶液和 溶液和 溶液 溶液 | 前者产生气泡速率快 |  的催化效果比 的催化效果比 好 好 |
| D | 分别在20℃、30℃下,取 KI溶液,向其中先加入 KI溶液,向其中先加入 的硫酸,再加入淀粉溶液,发生反应 的硫酸,再加入淀粉溶液,发生反应 | 30℃下,溶液更快出现蓝色 | 温度越高,化学反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 . 过氧化钙( CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105℃左右干燥即得白色或淡黄色粉末CaO2,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105℃左右干燥即得白色或淡黄色粉末CaO2,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。

您最近半年使用:0次



