1 . 葡萄酒常用 作抗氧化剂,
作抗氧化剂, 溶于水即生成
溶于水即生成 ,我国国家标准规定葡萄酒中
,我国国家标准规定葡萄酒中 残留量
残留量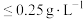 .测定某葡萄酒中抗氧化剂的残留量(以游离
.测定某葡萄酒中抗氧化剂的残留量(以游离 计算)的实验步骤如下:
计算)的实验步骤如下:
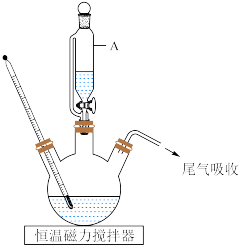
①按图示连接装置,检查装置气密性,加入药品。 的NaOH标准溶液滴定,消耗20.80mL。
的NaOH标准溶液滴定,消耗20.80mL。
③另取相同装置,向A中注入20.00mL蒸馏水和10mL 25%磷酸溶液,按同样的方法做空白实验,消耗NaOH溶液0.80mL。
回答下列问题:
(1) 溶于水的化学方程式为
溶于水的化学方程式为___________ 。
(2)装置B的名称是___________ ;使用装置D的目的是___________ ;E为直玻璃管,其作用是___________ 。
(3)真空泵抽气速率过快,导致的后果是___________ 。
(4)滴定指示剂可能是___________ ;滴定前,用标准NaOH溶液润洗滴定管的操作方法是___________ 。
(5)该葡萄酒中 的含量为
的含量为___________  。
。
 作抗氧化剂,
作抗氧化剂, 溶于水即生成
溶于水即生成 ,我国国家标准规定葡萄酒中
,我国国家标准规定葡萄酒中 残留量
残留量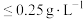 .测定某葡萄酒中抗氧化剂的残留量(以游离
.测定某葡萄酒中抗氧化剂的残留量(以游离 计算)的实验步骤如下:
计算)的实验步骤如下:①按图示连接装置,检查装置气密性,加入药品。

 的NaOH标准溶液滴定,消耗20.80mL。
的NaOH标准溶液滴定,消耗20.80mL。③另取相同装置,向A中注入20.00mL蒸馏水和10mL 25%磷酸溶液,按同样的方法做空白实验,消耗NaOH溶液0.80mL。
回答下列问题:
(1)
 溶于水的化学方程式为
溶于水的化学方程式为(2)装置B的名称是
(3)真空泵抽气速率过快,导致的后果是
(4)滴定指示剂可能是
(5)该葡萄酒中
 的含量为
的含量为 。
。
您最近半年使用:0次
名校
解题方法
2 . 下列各组离子或分子在给定条件的溶液中可能大量共存的是
A.加入铝片有大量氢气产生的溶液中: 、 、 、 、 、 、 |
B.在0.1mol/L的盐酸中: 、 、 、 、 、 、 |
C.在强碱性溶液中: 、 、 、 、 、 、 |
D.碱性无色溶液中: 、 、 、 、 、 、 |
您最近半年使用:0次
解题方法
3 . 对于下列实验,能正确描述其反应的离子方程式是
| A.FeSO4溶液与溴水反应:2Fe2++Br2=2Fe3++2Br- |
| B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+ |
| C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+ |
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合: +OH-=NH3·H2O +OH-=NH3·H2O |
您最近半年使用:0次
4 . 化学与生产、生活密切相关。下列有关叙述错误的是
| A.特氟龙(聚四氟乙烯)常用于不粘锅内层涂料 |
B.我国第一口海上 封存回注井开钻, 封存回注井开钻, 封存有利于实现碳中和 封存有利于实现碳中和 |
| C.“食人鱼溶液”是由浓硫酸和30%双氧水组成的混合物,它具有强氧化性和稳定性 |
| D.河北博物院收藏的“错金铜博山炉”,其主要材质是金属材料 |
您最近半年使用:0次
名校
解题方法
5 . 下列实验方案、现象、结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向饱和 溶液中加入少量 溶液中加入少量 粉末,过滤,在滤渣中加入盐酸 粉末,过滤,在滤渣中加入盐酸 | 产生气泡,固体部分溶解 |  |
| B | 将某卤代烃与NaOH水溶液共热,充分反应后,向溶液中先加入 ,再加入 ,再加入 | 产生白色沉淀 | 该卤代烃含氯元素 |
| C | 向等浓度等体积的 中分别加入等浓度等体积的 中分别加入等浓度等体积的 溶液和 溶液和 溶液 溶液 | 前者产生气泡速率快 |  的催化效果比 的催化效果比 好 好 |
| D | 分别在20℃、30℃下,取 KI溶液,向其中先加入 KI溶液,向其中先加入 的硫酸,再加入淀粉溶液,发生反应 的硫酸,再加入淀粉溶液,发生反应 | 30℃下,溶液更快出现蓝色 | 温度越高,化学反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
6 . 由实验操作和现象,可得出相应正确结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向热的浓硝酸中加入红热的木炭,继续加热 | 产生红棕色气体 | 不能说明木炭与浓硝酸一定发生了反应 |
| B | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 白色悬浊液中产生黑色沉淀 | Ksp(CuS)<<Ksp(ZnS) |
| C | 向0.1mol·L-1 KMnO4酸性溶液中滴加0.1mol·L-1H2O2溶液 | 溶液褪色 | H2O2具有漂白性 |
| D | 向淀粉溶液中滴加稀硫酸,水浴加热一段时间;再加入少量新制的Cu(OH)2悬浊液,加热3~5min | 无砖红色沉淀产生 | 淀粉未发生水解 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
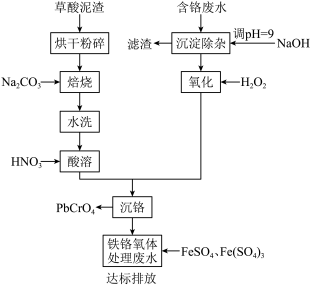
7 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-21更新
|
113次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
8 . 过氧化钙( CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105℃左右干燥即得白色或淡黄色粉末CaO2,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105℃左右干燥即得白色或淡黄色粉末CaO2,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。

您最近半年使用:0次
9 . 柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]易溶于水,不溶于乙醇等有机溶剂,是一种含铁量较高的补铁剂.实验室利用柠檬酸(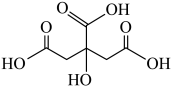 )制备柠檬酸铁铵的实验步骤如下:
)制备柠檬酸铁铵的实验步骤如下:
ii.降温至40℃,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵(NH4FeC6H5O7)。
iii.控温40℃,缓慢滴加一定量的双氧水充分反应,经一系列操作,得到产品。
回答下列问题:
(1)仪器A的名称是
(2)步骤i中,若柠檬酸加入量逐渐增多,最终会导致柠檬酸铁铵的含铁量逐渐减少,可能的原因是
(3)步骤ii、iii中均需控温40℃的原因是
(4)步骤iii中制备柠檬酸铁铵的化学方程式
(5)为了测定产品的纯度,实验的基本原理是将Fe3+还原成Fe2+后,采用分光光度法来测定纯度.实验时测得样品的纯度显著偏低,检查实验发现配制样品溶液时少加了一种还原试剂,该试剂应为
您最近半年使用:0次
名校
10 . 某实验小组通过下图所示实验,探究Na2O2与水的反应:
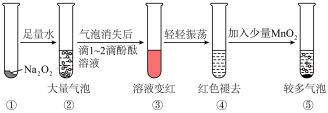
| A.②⑤中的气泡的主要成分相同,生成等物质的量的该气体转移电子的数目不同 |
| B.③中溶液变红,说明有碱性物质生成 |
| C.④中现象可能是由于溶液中含有漂白性物质造成的 |
| D.⑤中MnO2的主要作用是作催化剂 |
您最近半年使用:0次



