名校
解题方法
1 . 实验室利用含钴废催化剂制备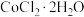 ,并利用其制备
,并利用其制备 。已知:
。已知: 完全沉淀的
完全沉淀的 为
为 ,
, 完全沉淀的
完全沉淀的 为
为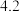 ,
, 开始沉淀的
开始沉淀的 为
为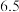 ,
, 的溶解度曲线如图-1所示。
的溶解度曲线如图-1所示。
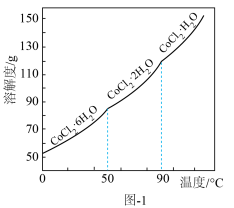
(1)制备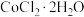 。
。
① 中
中 基态核外电子排布式为
基态核外电子排布式为___________ 。
②补充完整以含钴废催化剂(主要成分为 ,少量
,少量 和
和 )为原料制备
)为原料制备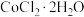 的实验方案:
的实验方案:___________ ,洗涤2~3次,低温干燥,得到产品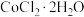 。(实验中须使用的仪器和试剂:
。(实验中须使用的仪器和试剂: 计、
计、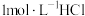 溶液、
溶液、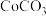 固体)
固体)
(2)制备 并测定
并测定 含量。将
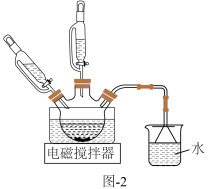
含量。将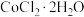 和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加
和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加 和浓氨水混合溶液、
和浓氨水混合溶液、 溶液,控制温度不超过
溶液,控制温度不超过 充分反应,冷却后过滤。
充分反应,冷却后过滤。
①三颈瓶中生成 反应的离子方程式为
反应的离子方程式为___________ 。
②加入 的作用是
的作用是___________ 。
③在没有活性炭存在时,能得到一种化学式为 的纯净物。测得
的纯净物。测得 与足量的硝酸银溶液反应生成
与足量的硝酸银溶液反应生成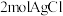 ,该配合物内界的化学式为
,该配合物内界的化学式为___________ 。
④准确称取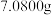 样品于烧杯中,加入足量
样品于烧杯中,加入足量 溶液充分反应,微沸加热至无
溶液充分反应,微沸加热至无 放出。冷却至室温后,加入过量的
放出。冷却至室温后,加入过量的 固体和盐酸,充分摇荡。将所得溶液定容至
固体和盐酸,充分摇荡。将所得溶液定容至 ,然后取出
,然后取出 溶液放入锥形瓶中,滴加少量淀粉溶液,用
溶液放入锥形瓶中,滴加少量淀粉溶液,用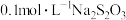 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算样品中钴元素的质量分数。
。计算样品中钴元素的质量分数。___________ 。已知: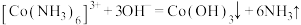 ,
,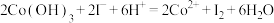 ,
, 。
。
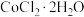 ,并利用其制备
,并利用其制备 。已知:
。已知: 完全沉淀的
完全沉淀的 为
为 ,
, 完全沉淀的
完全沉淀的 为
为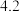 ,
, 开始沉淀的
开始沉淀的 为
为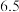 ,
, 的溶解度曲线如图-1所示。
的溶解度曲线如图-1所示。
(1)制备
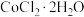 。
。①
 中
中 基态核外电子排布式为
基态核外电子排布式为②补充完整以含钴废催化剂(主要成分为
 ,少量
,少量 和
和 )为原料制备
)为原料制备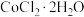 的实验方案:
的实验方案: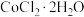 。(实验中须使用的仪器和试剂:
。(实验中须使用的仪器和试剂: 计、
计、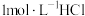 溶液、
溶液、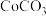 固体)
固体)(2)制备
 并测定
并测定 含量。将
含量。将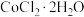 和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加
和活性炭(催化剂)加入三颈瓶中(装置见图-2),然后再依次通过滴液漏斗缓慢滴加 和浓氨水混合溶液、
和浓氨水混合溶液、 溶液,控制温度不超过
溶液,控制温度不超过 充分反应,冷却后过滤。
充分反应,冷却后过滤。
①三颈瓶中生成
 反应的离子方程式为
反应的离子方程式为②加入
 的作用是
的作用是③在没有活性炭存在时,能得到一种化学式为
 的纯净物。测得
的纯净物。测得 与足量的硝酸银溶液反应生成
与足量的硝酸银溶液反应生成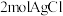 ,该配合物内界的化学式为
,该配合物内界的化学式为④准确称取
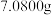 样品于烧杯中,加入足量
样品于烧杯中,加入足量 溶液充分反应,微沸加热至无
溶液充分反应,微沸加热至无 放出。冷却至室温后,加入过量的
放出。冷却至室温后,加入过量的 固体和盐酸,充分摇荡。将所得溶液定容至
固体和盐酸,充分摇荡。将所得溶液定容至 ,然后取出
,然后取出 溶液放入锥形瓶中,滴加少量淀粉溶液,用
溶液放入锥形瓶中,滴加少量淀粉溶液,用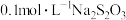 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算样品中钴元素的质量分数。
。计算样品中钴元素的质量分数。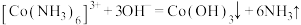 ,
,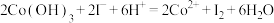 ,
, 。
。
您最近一年使用:0次
2024-01-28更新
|
857次组卷
|
3卷引用:2024届江苏省连云港市高三第一次调研考试(一模)化学试题
2024届江苏省连云港市高三第一次调研考试(一模)化学试题江苏省南菁高中、常州市第一中学2023-2024学年高二下学期3月月考化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
2 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。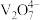 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,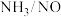 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以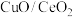 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。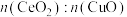 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。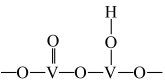
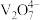 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,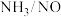 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
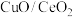 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
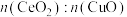 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近一年使用:0次
2024-01-21更新
|
392次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
3 . 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
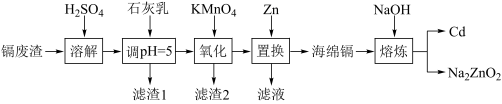
(1)Mn2+的基态核外电子排布式为________ 。
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为________ (填化学式)。
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为_______ 。
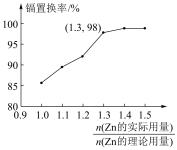
(4)“置换”中镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是_______ 。
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数_______ (写出计算过程)。

(1)Mn2+的基态核外电子排布式为
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为
(4)“置换”中镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数
您最近一年使用:0次
解题方法
4 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备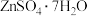 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取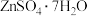 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: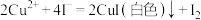 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
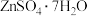 和
和 的部分实验步骤如下:
的部分实验步骤如下: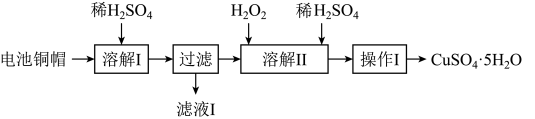
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取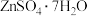 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
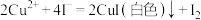 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
5 . 利用含硒物料(主要成分为Se、S、 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:

已知:硫单质熔点:单斜硫119℃、正交硫95℃;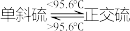 。
。
回答下列问题:
(1)“脱硫”选择温度为95℃的原因是___________ ;实验室进行“过滤”操作时,用到的玻璃仪器除烧杯外,还有___________ 。
(2)“氧化浸取”中,Se被氧化为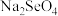 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为___________ 。
(3)“除杂”中, 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是___________ 。

(4)“酸化”过程中制取精硒的离子方程式为___________ 。
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为___________ 。上述过程发生的反应: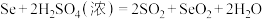 、
、 、
、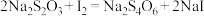
 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
已知:硫单质熔点:单斜硫119℃、正交硫95℃;
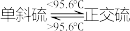 。
。回答下列问题:
(1)“脱硫”选择温度为95℃的原因是
(2)“氧化浸取”中,Se被氧化为
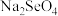 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为(3)“除杂”中,
 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
(4)“酸化”过程中制取精硒的离子方程式为
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓
 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为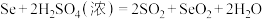 、
、 、
、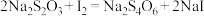
您最近一年使用:0次
2023-10-11更新
|
321次组卷
|
3卷引用:工业流程题
名校
6 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。
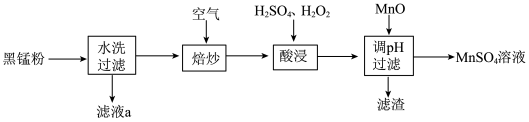
(1)Mn2+的价电子排布式为_______ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为_______ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是_______ ,实验Ⅱ中发生反应的离子方程式为_______ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是_______ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为_______ 。

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为_______ 。(写出计算过程)

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为
您最近一年使用:0次
解题方法
7 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
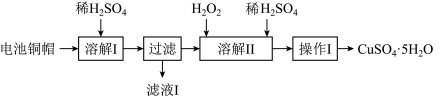
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_______ (任写一种方法)。
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_______ 、_______ 、过滤、冰水洗涤、低温干燥。
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为_______ (用双线桥标出电子转移的方向和数目)。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数_______ (写出计算过程,结果用百分数表示,小数点后保留1位有效数字)。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数
您最近一年使用:0次
名校
解题方法
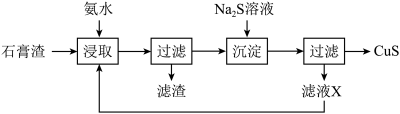
8 .  是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量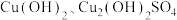 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
已知:常温下,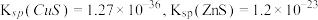 。
。
(1)“浸取”时,生成 与
与 等。
等。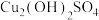 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
(2)“沉淀”时 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是_______ 。
(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有_______ 。
(4)为测定“浸取”时 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(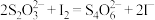 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液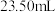 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)_______ 。
 是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量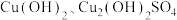 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
已知:常温下,
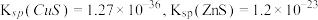 。
。(1)“浸取”时,生成
 与
与 等。
等。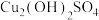 参加反应的离子方程式为
参加反应的离子方程式为(2)“沉淀”时
 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有
(4)为测定“浸取”时
 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(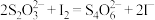 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液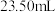 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)
您最近一年使用:0次
名校
9 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
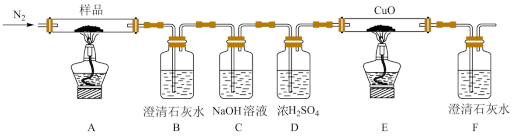
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:
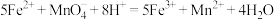
①配制溶液:实验中配制100 mL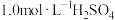 溶液,需要的仪器有烧杯、玻璃棒、量筒、
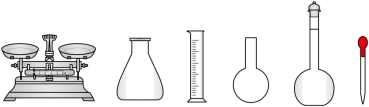
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加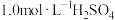 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加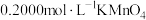 ,溶液至恰好完全反应。
,溶液至恰好完全反应。
步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用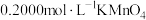 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

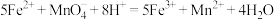
①配制溶液:实验中配制100 mL
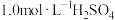 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
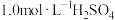 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加
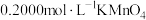 ,溶液至恰好完全反应。
,溶液至恰好完全反应。步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用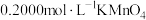 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含 和少量
和少量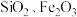 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
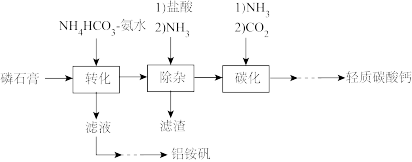
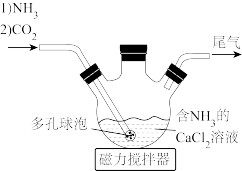
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,_________ 。
(2)“转化”步骤中 转化为
转化为 的化学方程式
的化学方程式_________ 。
(3)“除杂”时通入NH3的目的是_________ 。
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定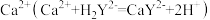 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数_________ 。(写出计算过程)。
(5)铝铵矾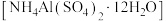 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
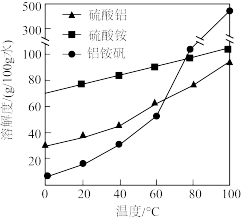
①_________ ,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体;②
固体;②_________ ,用无水乙醇洗涤,干燥,得到铝铵矾。(部分物质的溶解度随温度的变化如图所示,实验须用的试剂: 的
的 溶液、
溶液、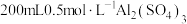 溶液)
溶液)
 和少量
和少量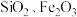 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,

(2)“转化”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)“除杂”时通入NH3的目的是
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液
 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定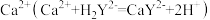 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数(5)铝铵矾
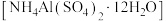 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:①
 固体;②
固体;② 的
的 溶液、
溶液、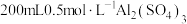 溶液)
溶液)
您最近一年使用:0次



