镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
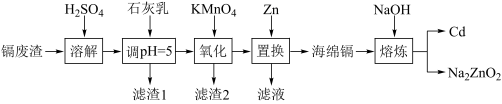
(1)Mn2+的基态核外电子排布式为________ 。
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为________ (填化学式)。
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为_______ 。
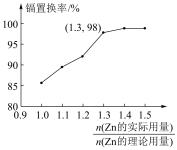
(4)“置换”中镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是_______ 。
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数_______ (写出计算过程)。

(1)Mn2+的基态核外电子排布式为
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为
(4)“置换”中镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数
更新时间:2023-11-25 21:16:02
|
【知识点】 物质分离、提纯综合应用解读
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某工厂的工业废水中含有大量的 FeSO4、较多的 CuSO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(图中所加试剂均为过量,流程图中无需填写)

(1)操作f的名称为____________ ,物质c的成分_________________
(2)试剂a的化学式为_____ ,加入该试剂所发生的化学方程式为______________ 。
(3) 请写出c→h+k的化学方程式______________

(1)操作f的名称为
(2)试剂a的化学式为
(3) 请写出c→h+k的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】全球对锂资源的需求不断增长。某锂离子电池正极材料有钴酸锂( )和铝箔等。现欲利用以下工艺流程回收锂资源(部分条件未给出)。
)和铝箔等。现欲利用以下工艺流程回收锂资源(部分条件未给出)。
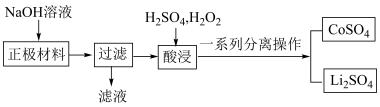
请回答下列问题:
(1) 中,Co元素的化合价为
中,Co元素的化合价为______ 。
(2)过滤操作用到的玻璃仪器有:______ 。
(3)写出“正极材料”碱浸中发生反应的离子方程式__________________ 。
(4)“酸浸”一般在:80℃下进行,写出该步骤中 发生的化学反应方程式
发生的化学反应方程式____________ ;“酸浸”温度不宜过高的原因是____________ ;
(5)可用盐酸代替 和
和 的混合液,但缺点是
的混合液,但缺点是____________ 。
 )和铝箔等。现欲利用以下工艺流程回收锂资源(部分条件未给出)。
)和铝箔等。现欲利用以下工艺流程回收锂资源(部分条件未给出)。
请回答下列问题:
(1)
 中,Co元素的化合价为
中,Co元素的化合价为(2)过滤操作用到的玻璃仪器有:
(3)写出“正极材料”碱浸中发生反应的离子方程式
(4)“酸浸”一般在:80℃下进行,写出该步骤中
 发生的化学反应方程式
发生的化学反应方程式(5)可用盐酸代替
 和
和 的混合液,但缺点是
的混合液,但缺点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】明矾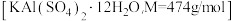 具有抗菌、收敛、净水等作用。现利用废旧铝制易拉罐制备明矾产品,并测定产品的纯度。回答下列问题:
具有抗菌、收敛、净水等作用。现利用废旧铝制易拉罐制备明矾产品,并测定产品的纯度。回答下列问题:
(1)将易拉罐溶于浓氢氧化钠溶液,并减压过滤。溶液中发生的主要反应离子方程式为_______ 。
(2)向滤液中滴加 溶液调pH,溶液中产生大量沉淀,下图是
溶液调pH,溶液中产生大量沉淀,下图是 溶解度随pH变化曲线,调节滤液的最佳pH范围为
溶解度随pH变化曲线,调节滤液的最佳pH范围为_______ (填字母标号)。
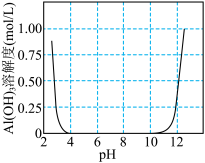
a.小于4 b.4~6 c.8~10 d.大于10
用pH试纸测量溶液pH的操作为_______ 。
(3)将沉淀溶于稀 ,然后加入
,然后加入 ,可得到明矾溶液。从溶液中获得大颗粒明矾晶体的操作依次是
,可得到明矾溶液。从溶液中获得大颗粒明矾晶体的操作依次是_______ (选填字母标号)。
a.抽滤 b.蒸发浓缩至出现较多量晶体 c.冰水冷却 d.自然冷却 e.蒸发浓缩至表面出现晶膜;
经无水乙醇洗涤后,所得明矾晶体中仍含有少量可溶性杂质,可采用的除杂方法为_______ 。
a.升华 b.蒸馏 c.重结晶 d.萃取
(4)已知 可与等物质的量的
可与等物质的量的 (或
(或 )结合。为测定产品的纯度,先称取ag产品于锥形瓶中,加水溶解,再加入
)结合。为测定产品的纯度,先称取ag产品于锥形瓶中,加水溶解,再加入
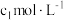
 溶液(过量)和指示剂,立即用
溶液(过量)和指示剂,立即用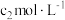 的
的 标准溶液滴定至终点。三次平行测定平均消耗
标准溶液滴定至终点。三次平行测定平均消耗 标准溶液
标准溶液 ,计算产品的纯度为
,计算产品的纯度为_______ %。
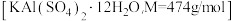 具有抗菌、收敛、净水等作用。现利用废旧铝制易拉罐制备明矾产品,并测定产品的纯度。回答下列问题:
具有抗菌、收敛、净水等作用。现利用废旧铝制易拉罐制备明矾产品,并测定产品的纯度。回答下列问题:(1)将易拉罐溶于浓氢氧化钠溶液,并减压过滤。溶液中发生的主要反应离子方程式为
(2)向滤液中滴加
 溶液调pH,溶液中产生大量沉淀,下图是
溶液调pH,溶液中产生大量沉淀,下图是 溶解度随pH变化曲线,调节滤液的最佳pH范围为
溶解度随pH变化曲线,调节滤液的最佳pH范围为
a.小于4 b.4~6 c.8~10 d.大于10
用pH试纸测量溶液pH的操作为
(3)将沉淀溶于稀
 ,然后加入
,然后加入 ,可得到明矾溶液。从溶液中获得大颗粒明矾晶体的操作依次是
,可得到明矾溶液。从溶液中获得大颗粒明矾晶体的操作依次是a.抽滤 b.蒸发浓缩至出现较多量晶体 c.冰水冷却 d.自然冷却 e.蒸发浓缩至表面出现晶膜;
经无水乙醇洗涤后,所得明矾晶体中仍含有少量可溶性杂质,可采用的除杂方法为
a.升华 b.蒸馏 c.重结晶 d.萃取
(4)已知
 可与等物质的量的
可与等物质的量的 (或
(或 )结合。为测定产品的纯度,先称取ag产品于锥形瓶中,加水溶解,再加入
)结合。为测定产品的纯度,先称取ag产品于锥形瓶中,加水溶解,再加入
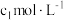
 溶液(过量)和指示剂,立即用
溶液(过量)和指示剂,立即用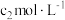 的
的 标准溶液滴定至终点。三次平行测定平均消耗
标准溶液滴定至终点。三次平行测定平均消耗 标准溶液
标准溶液 ,计算产品的纯度为
,计算产品的纯度为
您最近一年使用:0次



