1 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
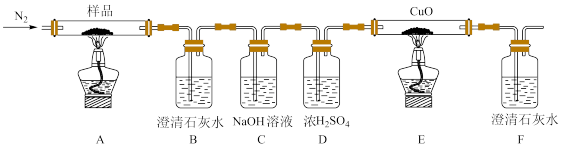
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

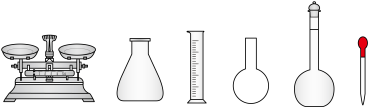
①配制溶液:实验中配制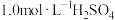 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加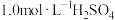 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加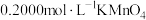 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是_______ 。
③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用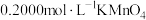 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制
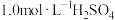 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
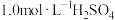 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加
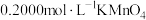 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用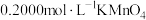 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
解题方法
2 . 某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。
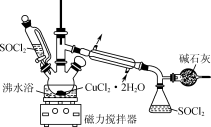
已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是___ 。
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为__ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为__ 。
②计算试样中铜元素的质量分数__ (写出计算过程)。

已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为
②计算试样中铜元素的质量分数
您最近一年使用:0次
2020-03-09更新
|
87次组卷
|
2卷引用:江苏省连云港市2019-2020学年高二学业水平合格性考试模拟试卷(12月) 化学试题
名校
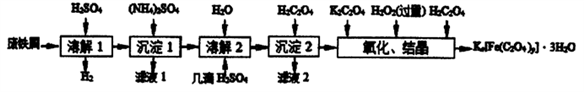
3 . 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________ 。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________ 、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____ 。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。

已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
| (NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为
您最近一年使用:0次
4 . (1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3; ②CH3CH2OH和CH3CH2CH2OH;
③CH3COOCH2CH3和CH3CH2CH2COOH; ④CH3CH=CHCH3和CH3CH2CH=CH2;
⑤ 和
和 。其中互为同分异构体的是
。其中互为同分异构体的是______________________ (填序号)。
(2)下列5种有机化合物:乙酸乙酯(CH3COOCH2CH3)、苯酚( )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
①其中能与Na2CO3溶液反应产生气泡的是______________________ 。
②其中能与FeCl3溶液发生显色反应的是________________________ 。
③其中能发生银镜反应的是________________________ 。
④写出乙酸乙酯碱性条件水解反应的化学方程式____________________________ 。
(3)①蛋白质是维持生命的重要物质,它是由_____________________ 通过缩聚反应生成的一类高分子化合物;氨基酸因分子中含有的官能团是____________________ 和____________________ ,而具有__________________ 性。
②2008年,三鹿婴幼儿奶粉由于人为添加三聚氰胺,导致长期食用该奶粉的部分婴幼儿出现肾结石病。三聚氰胺的结构简式如下图所示。

请你预测三聚氰胺在核磁共振氢谱图(1H核磁共振谱图)中会出现____________________ 个峰;三聚氰 胺中氮元素的质量分数为______________________ (结果用百分数表示,并保留一位小数),添加三聚氰胺会使食品中蛋白质的含量虚高。
①CH3CH2CH2CH3和(CH3)2CHCH3; ②CH3CH2OH和CH3CH2CH2OH;
③CH3COOCH2CH3和CH3CH2CH2COOH; ④CH3CH=CHCH3和CH3CH2CH=CH2;
⑤
 和
和 。其中互为同分异构体的是
。其中互为同分异构体的是(2)下列5种有机化合物:乙酸乙酯(CH3COOCH2CH3)、苯酚(
 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。①其中能与Na2CO3溶液反应产生气泡的是
②其中能与FeCl3溶液发生显色反应的是
③其中能发生银镜反应的是
④写出乙酸乙酯碱性条件水解反应的化学方程式
(3)①蛋白质是维持生命的重要物质,它是由
②2008年,三鹿婴幼儿奶粉由于人为添加三聚氰胺,导致长期食用该奶粉的部分婴幼儿出现肾结石病。三聚氰胺的结构简式如下图所示。

请你预测三聚氰胺在核磁共振氢谱图(1H核磁共振谱图)中会出现
您最近一年使用:0次
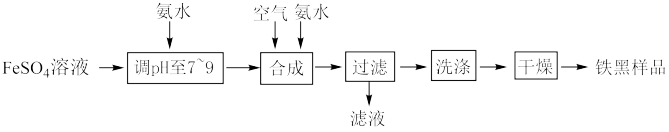
5 . 铁黑(Fe3O4)是常见的铁系颜料.一种制取铁黑的实验流程如下图所示:
制取铁黑的反应原理可表示为Fe(OH)2+2Fe(OH)3 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4
Fe3O4
(1)加入氨水调pH至7~9时,发生反应的离子方程式为_______________ 。
(2)为了保证铁黑样品的质量,“合成”中需要控制的因素有______________ (填三个)。
(3)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
恰好完全反应时,共消耗50.00mL K2Cr2O7溶液。请计算样品中Fe3O4的质量分数_____________ (写出计算过程)。
制取铁黑的反应原理可表示为Fe(OH)2+2Fe(OH)3
 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4
Fe3O4(1)加入氨水调pH至7~9时,发生反应的离子方程式为
(2)为了保证铁黑样品的质量,“合成”中需要控制的因素有
(3)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
恰好完全反应时,共消耗50.00mL K2Cr2O7溶液。请计算样品中Fe3O4的质量分数
您最近一年使用:0次
2017-03-30更新
|
242次组卷
|
2卷引用:2016-2017学年江苏省高二学业水平测试化学试卷
6 . 硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1) “氧化”步骤中,加入H2O2溶液的目的是________ (用离子方程式表示)。“沉淀”步骤中,用氨水调节pH的范围是________ 。
(2) “过滤”所得滤液中含有的阳离子为Mg2+、________ 。
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、____________________ 。
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数________ 。(写出计算过程)。
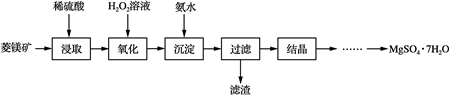
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
(1) “氧化”步骤中,加入H2O2溶液的目的是
(2) “过滤”所得滤液中含有的阳离子为Mg2+、
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数
您最近一年使用:0次
2011高二·江苏南通·学业考试
7 . 黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
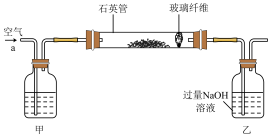
Ⅱ.反应结束后,将乙瓶中的溶液进行如下图所示处理。
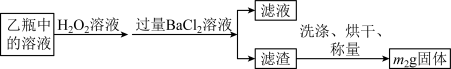
[实验二]测定铁元素的含量。
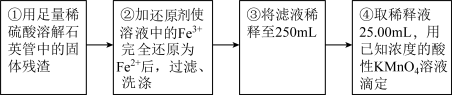
Ⅲ.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是____________ 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为_______ 。
Ⅱ中除了可以用H2O2溶液作为氧化剂,还可以加入____________ (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为___________________ 。
(4)Ⅲ的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)___________ (填“合理“或”不合理“)、_____ (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤Ⅲ中还需要测定的数据有______________ 。
[实验一]测定硫元素的含量。
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ.反应结束后,将乙瓶中的溶液进行如下图所示处理。

[实验二]测定铁元素的含量。
Ⅲ.测定铁元素的含量的实验步骤如下图所示。

问题讨论:
(1)上述装置中,甲瓶内所盛试剂是
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为
Ⅱ中除了可以用H2O2溶液作为氧化剂,还可以加入
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为
(4)Ⅲ的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)
(5)若要测定铁元素的含量,则步骤Ⅲ中还需要测定的数据有
您最近一年使用:0次
名校
解题方法
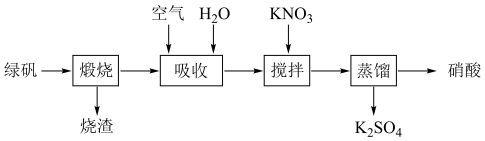
8 . 我国在明代就有了利用绿矾(FeSO4·7H2O)和硝酸钾制备硝酸的工艺,其主要流程如下:_______ 。
(2)“吸收”过程通入足量空气的目的是_______ 。
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有_______ (用化学式表示)。
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。___
(2)“吸收”过程通入足量空气的目的是
(3)“蒸馏”获得的硝酸液体显黄色是因为溶有
(4)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000 mol·L-1 KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液41.00 mL。
已知:8H++MnO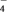 +5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
+5Fe2+=Mn2++5Fe3++4H2O。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
您最近一年使用:0次
2024-01-10更新
|
127次组卷
|
3卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题
名校
9 . 锰元素能形成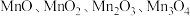 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为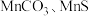 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知: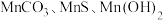 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢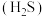 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
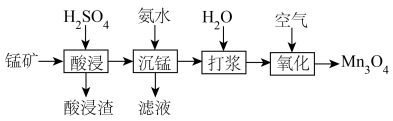
(1)“酸浸”: 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:___________ 。
(2)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
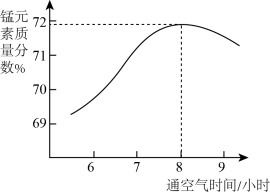
通空气超过8小时,产物中锰元素质量分数减小的原因是___________ 。
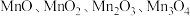 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为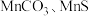 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:
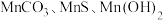 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢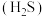 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
(1)“酸浸”:
 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:(2)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。

通空气超过8小时,产物中锰元素质量分数减小的原因是
您最近一年使用:0次
10 . 亚硝酸钠( )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:_____ 。
(2)还原:若硝酸在“还原”阶段只生成 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:____ 。
(3)测定产品中 纯度。实验操作如下:
纯度。实验操作如下:
ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: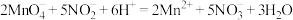 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。
ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会___________ (填“偏大”或“偏小”)。
②该亚硝酸钠晶体产品中可能含有的杂质有:___________ 、 和
和 。
。
③试计算产品中 纯度(即
纯度(即 的质量分数)是
的质量分数)是___________ (写出计算过程)。
 )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。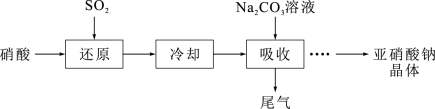
 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:(2)还原:若硝酸在“还原”阶段只生成
 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:(3)测定产品中
 纯度。实验操作如下:
纯度。实验操作如下:ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的
 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: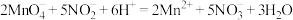 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会
②该亚硝酸钠晶体产品中可能含有的杂质有:
 和
和 。
。③试计算产品中
 纯度(即
纯度(即 的质量分数)是
的质量分数)是
您最近一年使用:0次
2023-12-22更新
|
203次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题



