名校
解题方法
1 . 草酸及其化合物在工业中有重要作用,例如:草酸可用于除铁锈,反应的离子方程式为: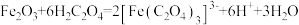 ;草酸铁铵[
;草酸铁铵[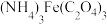 ]是一种常用的金属着色剂。
]是一种常用的金属着色剂。
(1)草酸( )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
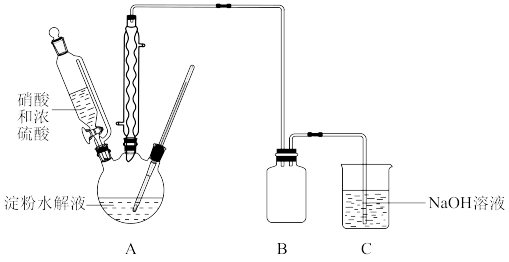
①葡萄糖溶液可由反应 得到。该实验中证明淀粉已经完全水解的实验操作及现象是
得到。该实验中证明淀粉已经完全水解的实验操作及现象是___________ 。
②55℃~60℃时,装置A中生成 ,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗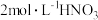 溶液的体积为
溶液的体积为___________ mL。
③该实验中催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(2)草酸铁铵晶体[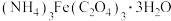 ]易溶于水,常温下其水溶液pH为4.0~5.0。设计以
]易溶于水,常温下其水溶液pH为4.0~5.0。设计以 、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:
、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:___________ 。
(3)制得的草酸铁铵晶体中往往会混有少量草酸,为测定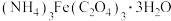 (M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:
(M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知: (未配平)。通过计算,确定样品中
(未配平)。通过计算,确定样品中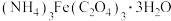 的质量分数
的质量分数___________ (写出计算过程)。
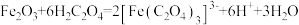 ;草酸铁铵[
;草酸铁铵[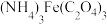 ]是一种常用的金属着色剂。
]是一种常用的金属着色剂。(1)草酸(
 )是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
)是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
①葡萄糖溶液可由反应
 得到。该实验中证明淀粉已经完全水解的实验操作及现象是
得到。该实验中证明淀粉已经完全水解的实验操作及现象是②55℃~60℃时,装置A中生成
 ,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗
,同时生成NO。要将16.2g淀粉完全水解后的淀粉水解液完全转化为草酸,理论上消耗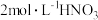 溶液的体积为
溶液的体积为③该实验中催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(2)草酸铁铵晶体[
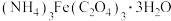 ]易溶于水,常温下其水溶液pH为4.0~5.0。设计以
]易溶于水,常温下其水溶液pH为4.0~5.0。设计以 、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:
、草酸溶液和氨水为原料,制备草酸铁铵晶体的实验方案:(3)制得的草酸铁铵晶体中往往会混有少量草酸,为测定
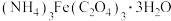 (M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:
(M=428g/mol)的含量,进行下列实验:称取样品9.46g,加稀硫酸溶解后,配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol/L的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知: (未配平)。通过计算,确定样品中
(未配平)。通过计算,确定样品中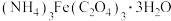 的质量分数
的质量分数
您最近一年使用:0次
2021-10-12更新
|
971次组卷
|
7卷引用:江苏省(盐城中学、南通中学)2021-2022学年高三上学期第一次大联考化学试题
江苏省(盐城中学、南通中学)2021-2022学年高三上学期第一次大联考化学试题江苏省扬州中学2021-2022学年高三下学期3月月考化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(江苏专用)江苏省徐州市第七中学2021-2022学年高三下学期4月学情调研化学试题江苏省南通市八校2022-2023学年高三上学期期初联考化学试题江苏省盐城市五校2023届高三上学期期末联考化学试题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
2 . 铅和锰是工业生产中的重要金属,利用软锰矿(主要成分 )和方铅矿(主要成分PbS,含少量
)和方铅矿(主要成分PbS,含少量 )协同浸出制取铅、锰氧化物是重要的化工方法。
)协同浸出制取铅、锰氧化物是重要的化工方法。
已知: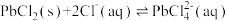
(1)在搅拌条件下将方铅矿、软锰矿和盐酸混合溶液进行混合,反应生成 和S。写出该过程中主要发生的化学方程式
和S。写出该过程中主要发生的化学方程式___________ 。
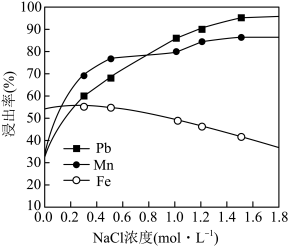
(2)研究表明加入氯化钠对体系中Pb、Mn、Fe元素的浸出率有影响,结果如图所示。随着氯化钠浓度的增大,铁元素的浸出率下降的原因是___________ 。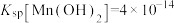 ,
,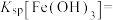
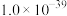 。若
。若 、
、 起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时
起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时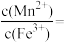
___________ 。
(4)氯化铅配合物与硫酸溶液反应生成 。利用
。利用 与
与 溶液进一步反应制取
溶液进一步反应制取 。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是
。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是___________ 。 、
、 后的溶液制备
后的溶液制备 。在弱碱性氨水溶液中,采用充氧氧化制备得到
。在弱碱性氨水溶液中,采用充氧氧化制备得到 ,写出该离子反应方程式
,写出该离子反应方程式___________ 。
(6)加热烘干 过程中常常混有
过程中常常混有 杂质,现对样品中
杂质,现对样品中 的含量进行测定。取
的含量进行测定。取 样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(
样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。( 和
和 在加热时均能和浓盐酸反应生成
在加热时均能和浓盐酸反应生成 )计算样品中
)计算样品中 的质量分数为
的质量分数为___________ 。(写出计算过程)
 )和方铅矿(主要成分PbS,含少量
)和方铅矿(主要成分PbS,含少量 )协同浸出制取铅、锰氧化物是重要的化工方法。
)协同浸出制取铅、锰氧化物是重要的化工方法。已知:
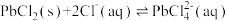
(1)在搅拌条件下将方铅矿、软锰矿和盐酸混合溶液进行混合,反应生成
 和S。写出该过程中主要发生的化学方程式
和S。写出该过程中主要发生的化学方程式(2)研究表明加入氯化钠对体系中Pb、Mn、Fe元素的浸出率有影响,结果如图所示。随着氯化钠浓度的增大,铁元素的浸出率下降的原因是
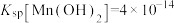 ,
,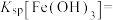
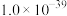 。若
。若 、
、 起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时
起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时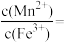
(4)氯化铅配合物与硫酸溶液反应生成
 。利用
。利用 与
与 溶液进一步反应制取
溶液进一步反应制取 。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是
。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是
 、
、 后的溶液制备
后的溶液制备 。在弱碱性氨水溶液中,采用充氧氧化制备得到
。在弱碱性氨水溶液中,采用充氧氧化制备得到 ,写出该离子反应方程式
,写出该离子反应方程式(6)加热烘干
 过程中常常混有
过程中常常混有 杂质,现对样品中
杂质,现对样品中 的含量进行测定。取
的含量进行测定。取 样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(
样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。( 和
和 在加热时均能和浓盐酸反应生成
在加热时均能和浓盐酸反应生成 )计算样品中
)计算样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
3 . 硫化物含硫量的测定、脱硫是极具价值的重要课题。
(1)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的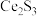 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为
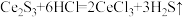
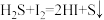

步骤1:称取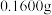 样品于反应瓶中,再准确滴加
样品于反应瓶中,再准确滴加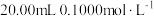 碘溶液;
碘溶液;
步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动 ;
;
步骤3:滴入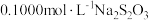 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
①Ce元素最高正化合价为_______ 。
②步骤1中不能使用稀硝酸的原因是_______ 。
③该样品中硫的质量分数为_______ (写出计算过程)。
(2)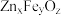 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
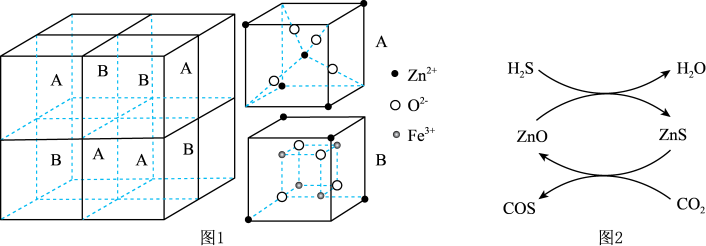
①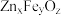 晶胞结构如图1所示(A、B分别为晶胞的
晶胞结构如图1所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为_______ 。
②一定温度下将一定比例 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为_______ 。
(1)稀土硫化物中硫含量的测定对其生产和质量控制具有重要意义。用如下方法对稀土硫化物中具有代表性的
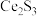 (
( 基态原子核外电子排布式为
基态原子核外电子排布式为 )样品硫含量进行测定。实验检测原理为
)样品硫含量进行测定。实验检测原理为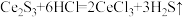
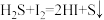

步骤1:称取
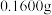 样品于反应瓶中,再准确滴加
样品于反应瓶中,再准确滴加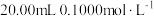 碘溶液;
碘溶液;步骤2:缓慢滴加稍过量的稀盐酸(边滴加边摇动反应瓶),盖上瓶塞,剧烈摇动
 ;
;步骤3:滴入
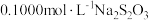 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。①Ce元素最高正化合价为
②步骤1中不能使用稀硝酸的原因是
③该样品中硫的质量分数为
(2)
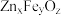 是一种复合脱硫剂,可用于脱除煤气中的
是一种复合脱硫剂,可用于脱除煤气中的 。
。
①
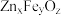 晶胞结构如图1所示(A、B分别为晶胞的
晶胞结构如图1所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为②一定温度下将一定比例
 和
和 的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到
的混合气体以一定流速通过装有上述脱硫剂的反应器,一段时间后,出口处检测到 。研究表明
。研究表明 参与了
参与了 与
与 生成
生成 的反应,反应机理如图2所示,反应前后
的反应,反应机理如图2所示,反应前后 的质量不变,该反应过程可描述为
的质量不变,该反应过程可描述为
您最近一年使用:0次
名校
4 . 二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒(IV)碱式碳酸铵晶体,过程如下:
V2O5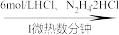 VOCl2溶液
VOCl2溶液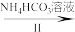 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为_______ 。已知:氧化性:V2O5>Cl2,则加入N2H4·2HCl的作用是_______ 。
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
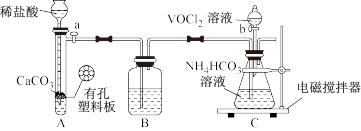
装置B中盛装的试剂是_______ ;向C中通入是CO2的作用是_______ 。
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为_______ ,接下来的简要操作是_______ ,最后用乙醚洗涤2-3次,干燥后称重。(所用药品为:饱和NH4HCO3溶液,无水乙醇)。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: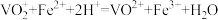 )
)
①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为_______ 。
②粗产品中钒元素的质量分数为_______ 。(保留四位有效数字)
V2O5
 VOCl2溶液
VOCl2溶液 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

装置B中盛装的试剂是
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO
 ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: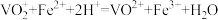 )
)①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
2022-03-22更新
|
1079次组卷
|
5卷引用:江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题
名校
解题方法
5 . 利用黄铁矿(主要成分为 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下: 、
、 、
、 等金属阳离子。
等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。 的价电子排布式为
的价电子排布式为___________ 。
②酸浸时反应生成 和S的离子方程式为
和S的离子方程式为___________ 。
③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是___________ 。
④酸浸液中还含有 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
___________ 。[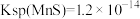 ,
,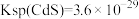 ]
]
(2) 溶液浸取滤渣时的反应为
溶液浸取滤渣时的反应为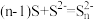 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是___________ 。 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用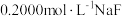 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用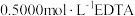 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数___________ 。(写出计算过程)
 )与软锰矿(主要成分为
)与软锰矿(主要成分为 )制备
)制备 并回收单质硫的部分工艺流程如下:
并回收单质硫的部分工艺流程如下: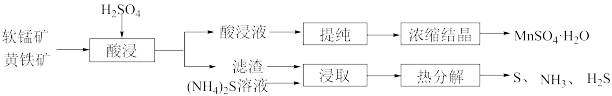
 、
、 、
、 等金属阳离子。
等金属阳离子。(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图1所示。

 的价电子排布式为
的价电子排布式为②酸浸时反应生成
 和S的离子方程式为
和S的离子方程式为③100min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是
④酸浸液中还含有
 等重金属阳离子,请结合数据说明能否用MnS除去
等重金属阳离子,请结合数据说明能否用MnS除去
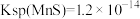 ,
,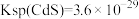 ]
](2)
 溶液浸取滤渣时的反应为
溶液浸取滤渣时的反应为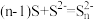 ,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图2所示。温度高于30℃,单质硫浸取率下降的可能原因是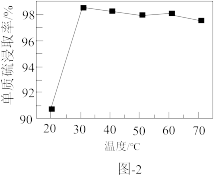
 产品中含有少量
产品中含有少量 和
和 杂质,进行以下实验测定产品中
杂质,进行以下实验测定产品中 含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用
含量:取10.00g产品溶于水,配成100mL溶液;取10.00mL所配溶液用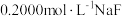 溶液滴定,消耗10.00mL;另取10.00mL所配溶液用
溶液滴定,消耗10.00mL;另取10.00mL所配溶液用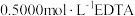 溶液滴定,消耗13.00mL。(已知:
溶液滴定,消耗13.00mL。(已知: 和
和 难溶于水;
难溶于水; 、
、 和
和 与EDTA按物质的量之比1∶1反应。),计算产品中
与EDTA按物质的量之比1∶1反应。),计算产品中 的质量分数
的质量分数
您最近一年使用:0次
2022-01-24更新
|
318次组卷
|
2卷引用:江苏省泰州市2021-2022学年高三上学期期末考试化学试题
6 . 使用硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]滴定法可以测定青铜中铬元素的含量。实验步骤如下:
步骤1:称量硫酸亚铁铵晶[(NH4)2Fe(SO4)2·6H2O]溶于稀硫酸,加水稀释配成1000 mL0.0200 mol/L (NH4)2Fe(SO4)2标准溶液。
步骤2:称取1.00 g青铜样品于250 mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过二硫酸铵[(NH4)2S2O8]溶液,加热煮沸,使样品中的铬元素完全转化为H2CrO4,冷却后加蒸馏水配制成250 mL溶液,摇匀。
步骤3:取25 mL上述溶液置于锥形瓶中,加入硫酸酸化,滴入4滴N-苯代邻氨基苯甲酸指示剂,用(NH4)2Fe(SO4)2标准溶液满淀至终点。重复上述操作3次。测得消耗(NH4)2Fe(SO4)2标准溶液的体积分别为18.90 mL、17.97 mL、18.03 mL。发生反应的离子方程式为:H2CrO4+Fe2++H+→Cr3++Fe3++H2O (未配平)
下列说法不正确的是
步骤1:称量硫酸亚铁铵晶[(NH4)2Fe(SO4)2·6H2O]溶于稀硫酸,加水稀释配成1000 mL0.0200 mol/L (NH4)2Fe(SO4)2标准溶液。
步骤2:称取1.00 g青铜样品于250 mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过二硫酸铵[(NH4)2S2O8]溶液,加热煮沸,使样品中的铬元素完全转化为H2CrO4,冷却后加蒸馏水配制成250 mL溶液,摇匀。
步骤3:取25 mL上述溶液置于锥形瓶中,加入硫酸酸化,滴入4滴N-苯代邻氨基苯甲酸指示剂,用(NH4)2Fe(SO4)2标准溶液满淀至终点。重复上述操作3次。测得消耗(NH4)2Fe(SO4)2标准溶液的体积分别为18.90 mL、17.97 mL、18.03 mL。发生反应的离子方程式为:H2CrO4+Fe2++H+→Cr3++Fe3++H2O (未配平)
下列说法不正确的是
| A.在“步骤1”中,用到的玻璃仪器有1000 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
B.在“步骤2”中,铜与硝酸反应的离子方程式为:3Cu+2 +8H+=3Cu2++2NO↑+4H2O +8H+=3Cu2++2NO↑+4H2O |
| C.青铜中铬元素的质量分数为6.344% |
| D.实验中,如果盛放(NH4)2Fe(SO4)2标准溶液的滴定管没有润洗,则测量结果将偏大 |
您最近一年使用:0次
7 . 实验室以活性炭为催化剂,用 制取三氯化六氨合钴(Ⅲ){
制取三氯化六氨合钴(Ⅲ){ },装置如图所示。
},装置如图所示。

已知:① 具有较强还原性;溶液呈棕色。②
具有较强还原性;溶液呈棕色。②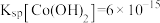 。回答下列问题:
。回答下列问题:
(1)仪器a的名称是_______ ;仪器b中的试剂是_______ 。
(2)产品制备.检查装置气密性并将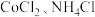 和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色,
和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色, 的作用是
的作用是_______ ;充分反应后缓慢滴加双氧水,水浴加热 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_______ 。
(3)产品分离提纯。将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到 晶体。该过程中加入浓盐酸的目的是
晶体。该过程中加入浓盐酸的目的是_______ 。
(4)测定产品中 的含量。实验如下:
的含量。实验如下:
①蒸氨:取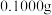 样品加入三颈烧瓶中,再加入足量
样品加入三颈烧瓶中,再加入足量 溶液并加热,蒸出的
溶液并加热,蒸出的 通入含有
通入含有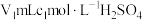 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。
②滴定:用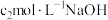 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。滴定时选用的指示剂为
溶液。滴定时选用的指示剂为_______ , 的质量分数为
的质量分数为_______ ;若 溶液使用前敞口放置于空气中一段时间,测得
溶液使用前敞口放置于空气中一段时间,测得 的含量
的含量_______ (填“偏高”、“偏低”或“无影响”)。
 制取三氯化六氨合钴(Ⅲ){
制取三氯化六氨合钴(Ⅲ){ },装置如图所示。
},装置如图所示。
已知:①
 具有较强还原性;溶液呈棕色。②
具有较强还原性;溶液呈棕色。②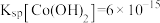 。回答下列问题:
。回答下列问题:(1)仪器a的名称是
(2)产品制备.检查装置气密性并将
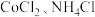 和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色,
和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色, 的作用是
的作用是 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(3)产品分离提纯。将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到
 晶体。该过程中加入浓盐酸的目的是
晶体。该过程中加入浓盐酸的目的是(4)测定产品中
 的含量。实验如下:
的含量。实验如下:①蒸氨:取
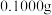 样品加入三颈烧瓶中,再加入足量
样品加入三颈烧瓶中,再加入足量 溶液并加热,蒸出的
溶液并加热,蒸出的 通入含有
通入含有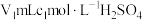 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。②滴定:用
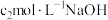 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。滴定时选用的指示剂为
溶液。滴定时选用的指示剂为 的质量分数为
的质量分数为 溶液使用前敞口放置于空气中一段时间,测得
溶液使用前敞口放置于空气中一段时间,测得 的含量
的含量
您最近一年使用:0次
2022-02-22更新
|
768次组卷
|
5卷引用:押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)山东省临沂市2022届高三下学期一模考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)四川省成都市石室中学2021-2022学年高二下学期4月月考试化学试题
名校
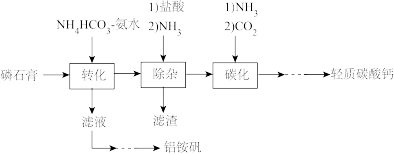
8 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含CaSO4和少量SiO2、Fe2O3等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:____ 。
(2)“除杂”时通入NH3的目的是____ 。
(3)“碳化”过程在如图所示的装置中进行。多孔球泡的作用是____ 。____ (写出计算过程)。
(5)铝铵矾[NH4Al(SO4)2·12H2O]是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:____ ,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得(NH4)2SO4固体;____ ,过滤,用无水乙醇洗涤、干燥,得到铝铵矾。(部分物质的溶解度随温度的变化如图所示,实验须用的试剂:3mol·L-1的H2SO4溶液、100mL1mol·L-1Al2(SO4)3溶液)
(2)“除杂”时通入NH3的目的是
(3)“碳化”过程在如图所示的装置中进行。多孔球泡的作用是
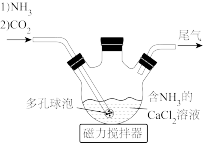
(5)铝铵矾[NH4Al(SO4)2·12H2O]是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
您最近一年使用:0次
2022-05-07更新
|
602次组卷
|
2卷引用:江苏省南京市2022届高三下学期第二次(5月)模拟考试化学试题
名校
解题方法
9 . 规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废磷酸铁锂粉主要成分为LiFePO4,还含有杂质铝、铜、镁。回收LiCl的工艺流程如下:
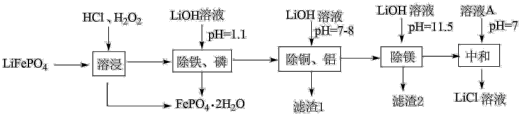
(1)LiFePO4中Fe的化合价为_______ ,Fe在周期表中的位置为_______ 。
(2)溶液A为_______ 。
(3)“溶浸”可得到含氯化锂的浸出液,材料中的杂质铝、铜、镁等金属杂质也会溶入浸出液,生成氯化铜的离子方程式为_______ 。生成FePO4·2H2O的离子方程式为_______ 。
(4)工业通过处理废旧钴酸锂电池正极材料(主要成分为LiCoO2,含少量金属Cu等)回收Co和Li。
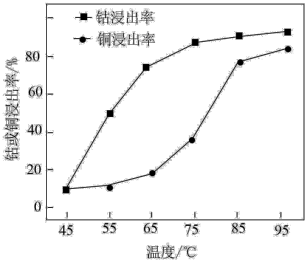
①将预处理后的正极材料粉碎,加入3mol·L-1硫酸和30%H2O2的混合溶液。写出酸浸时生成Li2SO4和CoSO4的化学方程式:_______ 。其他条件相同,浸泡1h,不同温度下钴或铜的浸出率如下图所示。从75℃~85℃,铜浸出率增大的幅度明显高于65℃~75℃增大的幅度,原因是_______ 。
②沉钴,回收Co(OH)2,测定Co(OH)2的含量。Co(OH)2在空气中易被氧化为CoOOH。在稀硫酸中加入0.1000gCo(OH)2样品,待样品完全溶解后加入1.000gKI固体。充分反应后,调节溶液pH=3~4。以淀粉作指示剂,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知:Co3++I-→Co2++I2(未配平);I2+S2O →I-+S4O
→I-+S4O (未配平)。计算样品中Co(OH)2的质量分数
(未配平)。计算样品中Co(OH)2的质量分数_______ (写出计算过程)。

(1)LiFePO4中Fe的化合价为
(2)溶液A为
(3)“溶浸”可得到含氯化锂的浸出液,材料中的杂质铝、铜、镁等金属杂质也会溶入浸出液,生成氯化铜的离子方程式为
(4)工业通过处理废旧钴酸锂电池正极材料(主要成分为LiCoO2,含少量金属Cu等)回收Co和Li。
①将预处理后的正极材料粉碎,加入3mol·L-1硫酸和30%H2O2的混合溶液。写出酸浸时生成Li2SO4和CoSO4的化学方程式:

②沉钴,回收Co(OH)2,测定Co(OH)2的含量。Co(OH)2在空气中易被氧化为CoOOH。在稀硫酸中加入0.1000gCo(OH)2样品,待样品完全溶解后加入1.000gKI固体。充分反应后,调节溶液pH=3~4。以淀粉作指示剂,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知:Co3++I-→Co2++I2(未配平);I2+S2O
 →I-+S4O
→I-+S4O (未配平)。计算样品中Co(OH)2的质量分数
(未配平)。计算样品中Co(OH)2的质量分数
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。
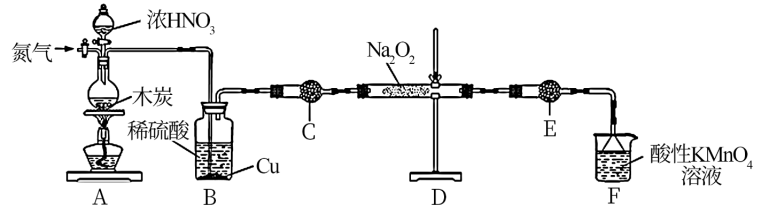
已知:
①2NO+Na2O2= 2NaNO2;
②2NO2+Na2O2= 2NaNO3;
③3NaNO2+3HCl=3NaCl+HNO3+ 2NO↑+H2O;
④酸性条件下,NO和NO2都能与MmO 反应生成NO
反应生成NO 和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,通 N2目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)写出B瓶中Cu发生的有关离子反应_______ ;
(4)写出装置C的作用_______ ;
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2(注明试剂、现象)。
(6)写出装置F中离子反应_______ ;
(7)为测定亚硝酸钠的含量,称取3.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,再向锥形瓶中加入0. 1000mol/L酸性KMnO4溶液16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①2NO+Na2O2= 2NaNO2;
②2NO2+Na2O2= 2NaNO3;
③3NaNO2+3HCl=3NaCl+HNO3+ 2NO↑+H2O;
④酸性条件下,NO和NO2都能与MmO
 反应生成NO
反应生成NO 和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,通 N2目的是
(2)装置A中发生反应的化学方程式为
(3)写出B瓶中Cu发生的有关离子反应
(4)写出装置C的作用
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)写出装置F中离子反应
(7)为测定亚硝酸钠的含量,称取3.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,再向锥形瓶中加入0. 1000mol/L酸性KMnO4溶液16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2022-04-19更新
|
750次组卷
|
2卷引用:江苏省沙溪高级中学等三校2021-2022学年高一下学期4月线上教学质量调研化学试题



