名校
1 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
(1)制备NH4SCN溶液
①实验前,经检验装置的气密性良好。其中装置B中的试剂是_______ 。
②实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
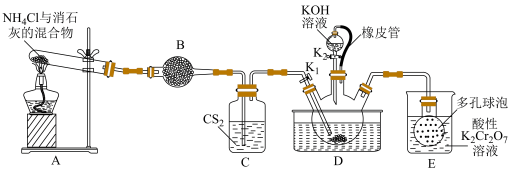
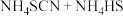 该反应比较缓慢),当看到
该反应比较缓慢),当看到_______ 现象时说明该反应接近完全。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS=H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为_______ 。
②装置E中多孔球泡的作用是_______ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,蒸发浓缩、降温结晶,过滤、洗涤、干燥,得到硫氰化钾晶体。
补充完整实验步骤:测定晶体中KSCN的含量:称取10.0g样品,配成500mL溶液。量取20.00mL溶液于锥形瓶中,_______ 消耗标准溶液20.00mL(须使用的试剂:稀硝酸、Fe(NO3)3,0.1000mol/LAgNO3溶液)。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色)。则判断到达滴定终点的方法是_______ 。
②晶体中KSCN的质量分数为_______ (结果精确至0.1%)。
(1)制备NH4SCN溶液
①实验前,经检验装置的气密性良好。其中装置B中的试剂是
②实验开始时,打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应

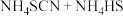 该反应比较缓慢),当看到
该反应比较缓慢),当看到(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS=H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
②装置E中多孔球泡的作用是
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,蒸发浓缩、降温结晶,过滤、洗涤、干燥,得到硫氰化钾晶体。
补充完整实验步骤:测定晶体中KSCN的含量:称取10.0g样品,配成500mL溶液。量取20.00mL溶液于锥形瓶中,
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色)。则判断到达滴定终点的方法是
②晶体中KSCN的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图:
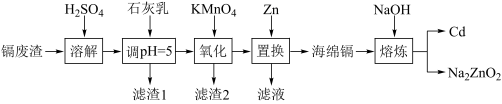
(1)Mn2+的基态核外电子排布式为________ 。
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为________ (填化学式)。
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为_______ 。
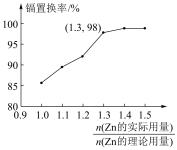
(4)“置换”中镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是_______ 。
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的_______ 不同,将Cd从反应釜下口放出,以达到分离的目的。
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数_______ (写出计算过程)。

(1)Mn2+的基态核外电子排布式为
(2)加石灰乳调节pH=5目的是除铜,“滤渣1”的主要成分为
(3)“氧化”时为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除锰的离子方程式为
(4)“置换”中镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。实际生产中 比值最佳为1.3,不宜超过该比值的原因是
比值最佳为1.3,不宜超过该比值的原因是
(5)“熔炼”时,当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的
(6)向“置换”所得溶液经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[Zn4CO3(OH)6]。用乙二胺四乙酸(俗称EDTA,H2Y2-表示乙二胺四乙酸根离子)滴定法测样品中锌的含量,反应原理:Zn2++H2Y2-=ZnY2-+2H+。取1.840g碱式碳酸锌样品,溶于pH为5~6的乙酸-乙酸钠缓冲溶液中配成100mL溶液,滴入少量的铬黑T作指示剂,取25.00mL置于锥形瓶中,向锥形瓶中加入过量的10.00mL2.000mol•L-1EDTA,振荡。用1.000mol•L-1锌离子标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL。求样品中Zn元素的质量分数
您最近一年使用:0次
解题方法
3 . 碱式次氯酸镁[化学式为Mg2ClO(OH)3·H2O]是一种白色粉末,难溶于水,也是新一代无机抗菌剂。可由Cl2、NaOH及MgCl2为原料制取。
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。
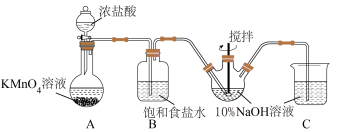
①B装置中饱和食盐水的作用为___________ 。
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式___________ ,因此控制反应在0~5℃范围内进行,实验中适宜的措施是___________ 。
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:
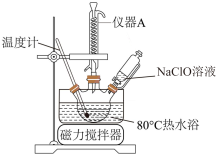
步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A___________ (填"上口"或“下口"”) 进入。
②过滤时,需用到的玻璃仪器除烧杯外,还需___________ 。
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:___________ 。
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=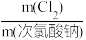 ×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2
×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应,测得有效氯含量为
)恰好完全反应,测得有效氯含量为___________ 。(写出计算过程)
(1)甲同学拟利用如图装置制备质量分数约为5%的次氯酸钠溶液。

①B装置中饱和食盐水的作用为
②Cl2和NaOH在较高的温度下反应生成NaClO3,写出该反应的离子反应方程式
(2)乙同学拟利用甲同学制得的NaClO溶液制取碱式次氯酸镁,步骤如下:

步骤1:往烧瓶中加入氯化镁,开动搅拌器并升温到80℃;
步骤2:逐滴滴入NaClO溶液;
步骤3:调节溶液pH=10,回流反应4h;
步骤4:过滤,烘干。
①上图中,冷凝水从仪器A
②过滤时,需用到的玻璃仪器除烧杯外,还需
③写出MgCl2、NaOH、Cl2反应制取Mg2ClO(OH)3·H2O的化学方程式:
④通过测定Mg2ClO(OH)3·H2O产品有效氯的含量来衡量产品品质。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,有效氯含量=
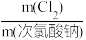 ×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2
×100%。实测值的测量方法:称取1.775g所制得的碱式次氯酸镁,放置于带塞的磨口瓶中,加入稍过量KI溶液和稀硫酸(ClO-+2I-+2H+=I2+Cl-+H2O),滴入20.00mL1mol/LNa2S2O3溶液(I2+2 =2I-+
=2I-+ )恰好完全反应,测得有效氯含量为
)恰好完全反应,测得有效氯含量为
您最近一年使用:0次
名校
4 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
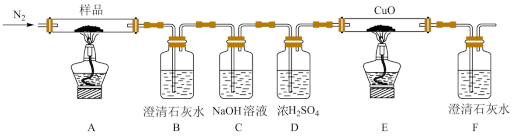
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

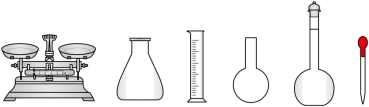
①配制溶液:实验中配制100 mL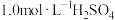 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加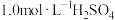 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加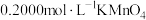 ,溶液至恰好完全反应。
,溶液至恰好完全反应。
步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用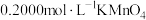 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制100 mL
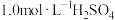 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
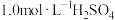 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加
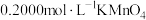 ,溶液至恰好完全反应。
,溶液至恰好完全反应。步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用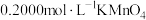 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
解题方法
5 . 利用含硒物料(主要成分为Se、S、 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:

已知:硫单质熔点:单斜硫119℃、正交硫95℃;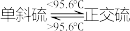 。
。
回答下列问题:
(1)“脱硫”选择温度为95℃的原因是___________ ;实验室进行“过滤”操作时,用到的玻璃仪器除烧杯外,还有___________ 。
(2)“氧化浸取”中,Se被氧化为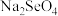 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为___________ 。
(3)“除杂”中, 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是___________ 。

(4)“酸化”过程中制取精硒的离子方程式为___________ 。
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为___________ 。上述过程发生的反应: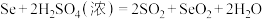 、
、 、
、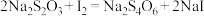
 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
已知:硫单质熔点:单斜硫119℃、正交硫95℃;
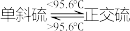 。
。回答下列问题:
(1)“脱硫”选择温度为95℃的原因是
(2)“氧化浸取”中,Se被氧化为
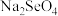 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为(3)“除杂”中,
 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
(4)“酸化”过程中制取精硒的离子方程式为
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓
 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为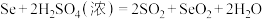 、
、 、
、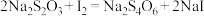
您最近一年使用:0次
2023-10-11更新
|
321次组卷
|
3卷引用:工业流程题
名校
6 . 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。
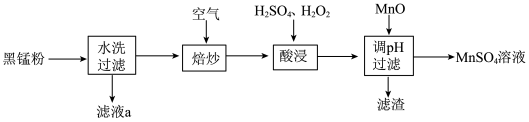
(1)Mn2+的价电子排布式为_______ 。
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为_______ 。
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是_______ ,实验Ⅱ中发生反应的离子方程式为_______ 。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是_______ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为_______ 。

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为_______ 。(写出计算过程)

(1)Mn2+的价电子排布式为
(2)“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为
(3)探究“酸浸”中MnO2溶解的适宜操作。
实验I.向MnO2中加入H2O2溶液,产生大量气泡:再加入稀H2SO4,固体未明显溶解。
实验Ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。β-MnSe中Mn的配位数为

(5)MnSO4可通过反应制得Mn3O4,在加热烘干Mn3O4过程中常常混有Mn2O3杂质,现对样品中Mn3O4的含量进行测定。取Mn3O4样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(Mn3O4和Mn2O3在加热时均能和浓盐酸反应生成MnCl2)计算样品中Mn2O3的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含 和少量
和少量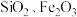 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
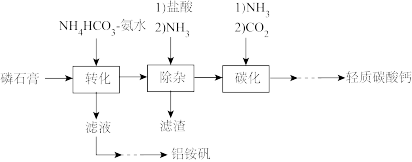
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,_________ 。
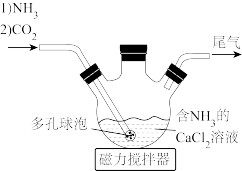
(2)“转化”步骤中 转化为
转化为 的化学方程式
的化学方程式_________ 。
(3)“除杂”时通入NH3的目的是_________ 。
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定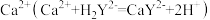 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数_________ 。(写出计算过程)。
(5)铝铵矾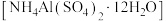 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
①_________ ,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体;②
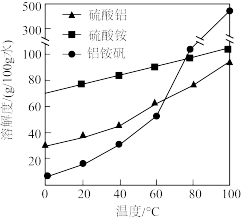
固体;②_________ ,用无水乙醇洗涤,干燥,得到铝铵矾。(部分物质的溶解度随温度的变化如图所示,实验须用的试剂: 的
的 溶液、
溶液、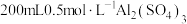 溶液)
溶液)
 和少量
和少量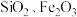 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
(1)检查图中所示装置气密性的操作为:用止水夹关闭左侧导管,

(2)“转化”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)“除杂”时通入NH3的目的是
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A。取25.00mL试液
 ,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定
,加入指示剂,调节pH>12,用0.02000mol/LNa2H2Y标准溶液滴定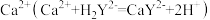 ,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数
,至终点时消耗Na2H2Y溶液24.60mL。计算产品中碳酸钙的质量分数(5)铝铵矾
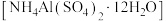 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案:①
 固体;②
固体;② 的
的 溶液、
溶液、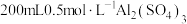 溶液)
溶液)
您最近一年使用:0次
名校
8 . 某种胃药的有效成分为碳酸钙.某实验小组为测定其中碳酸钙的含量.取10粒药片(0.1g/粒)研碎后溶解.加入25.00mL NaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
NaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
(1)配制500mL 的NaOH溶液,需要NaOH的质量是
的NaOH溶液,需要NaOH的质量是____________ 。
(2)药片中碳酸钙的质量分数_________ 。(写出计算过程)
 NaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
NaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
V(NaOH)/mL | 13.00 | 12.90 | 11.40 | 13.10 |
 的NaOH溶液,需要NaOH的质量是
的NaOH溶液,需要NaOH的质量是(2)药片中碳酸钙的质量分数
您最近一年使用:0次
名校
解题方法
9 .  是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量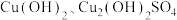 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
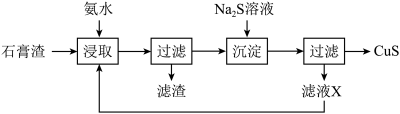
已知:常温下,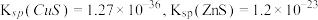 。
。
(1)“浸取”时,生成 与
与 等。
等。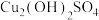 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
(2)“沉淀”时 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是_______ 。
(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有_______ 。
(4)为测定“浸取”时 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(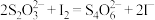 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液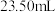 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)_______ 。
 是一种重要的P型半导体材料。以一种石膏渣[含
是一种重要的P型半导体材料。以一种石膏渣[含 及少量
及少量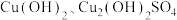 、
、 等]为原料制备
等]为原料制备 的实验流程如下:
的实验流程如下:
已知:常温下,
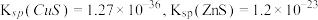 。
。(1)“浸取”时,生成
 与
与 等。
等。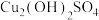 参加反应的离子方程式为
参加反应的离子方程式为(2)“沉淀”时
 溶液的用量不宜过多,其原因是
溶液的用量不宜过多,其原因是(3)循环“浸取”多次后,“滤液X”中浓度增大的阳离子主要有
(4)为测定“浸取”时
 元素浸出率,需先测定石膏渣中
元素浸出率,需先测定石膏渣中 元素含量。称取
元素含量。称取 石膏渣,加入足量稀
石膏渣,加入足量稀 充分溶解,过滤并洗涤滤渣,将滤液转移至
充分溶解,过滤并洗涤滤渣,将滤液转移至 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,加入足量KI溶液(
稀释后的溶液于锥形瓶中,加入足量KI溶液( ),用
),用 标准溶液滴定至终点(
标准溶液滴定至终点(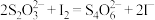 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液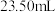 。计算石膏渣中
。计算石膏渣中 元素质量分数(写出计算过程)
元素质量分数(写出计算过程)
您最近一年使用:0次
解题方法
10 . 回收再利用金属冶炼厂的酸性废水(主要含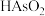 、
、 、
、 、
、 、
、 ),制备亚砷酸铜
),制备亚砷酸铜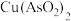 的流程如下。
的流程如下。
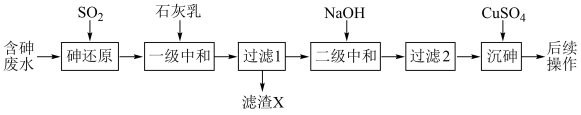
(1)基态砷原子的电子排布式为_______ 。
(2)砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入 ,能把五价砷转化为三价砷。
,能把五价砷转化为三价砷。
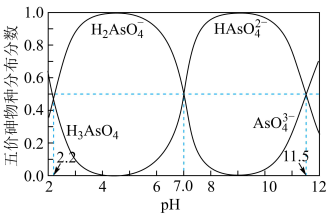
① 的二级电离平衡常数
的二级电离平衡常数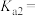
_______ 。
②pH为1时“还原”的主要反应的离子方程式为_______ 。
(3)中和除杂。当溶液中离子浓度小于 ,可认为已经完全除去。
,可认为已经完全除去。
已知: 在
在 时开始转化为
时开始转化为 ,
,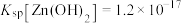 ,
, ,
, 。
。
①一级中和控制pH为2左右,滤渣X的主要成分有_______ 。
②二级中和沉淀重金属离子应控制pH范围为_______ 。
(4)应用碘量法可测定亚砷酸铜中的铜含量。称取2.000g试样溶于稀 搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成
搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成 溶液,取
溶液,取 所配溶液于碘量瓶中加入过量的碘化钾溶液,用
所配溶液于碘量瓶中加入过量的碘化钾溶液,用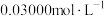
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。
①计算样品中铜元素的质量分数_______ 。(写出计算过程)
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为_______ 。(已知: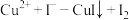 ;
;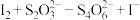 ,未配平)
,未配平)
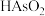 、
、 、
、 、
、 、
、 ),制备亚砷酸铜
),制备亚砷酸铜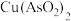 的流程如下。
的流程如下。
(1)基态砷原子的电子排布式为
(2)砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入
 ,能把五价砷转化为三价砷。
,能把五价砷转化为三价砷。
①
 的二级电离平衡常数
的二级电离平衡常数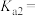
②pH为1时“还原”的主要反应的离子方程式为
(3)中和除杂。当溶液中离子浓度小于
 ,可认为已经完全除去。
,可认为已经完全除去。已知:
 在
在 时开始转化为
时开始转化为 ,
,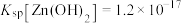 ,
, ,
, 。
。①一级中和控制pH为2左右,滤渣X的主要成分有
②二级中和沉淀重金属离子应控制pH范围为
(4)应用碘量法可测定亚砷酸铜中的铜含量。称取2.000g试样溶于稀
 搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成
搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成 溶液,取
溶液,取 所配溶液于碘量瓶中加入过量的碘化钾溶液,用
所配溶液于碘量瓶中加入过量的碘化钾溶液,用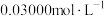
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 。
。①计算样品中铜元素的质量分数
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为
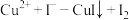 ;
;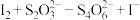 ,未配平)
,未配平)
您最近一年使用:0次



