解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。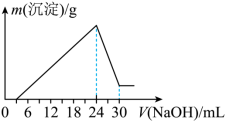
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 化学兴趣小组为测定某大理石样品中CaCO3的含量,进行如下实验:取18.0g样品置于烧杯中,向其中加入质量分数为5%的稀盐酸(样品中杂质不与盐酸反应),测得生成气体的质量与加入盐酸的质量关系如图所示,请回答下列问题。
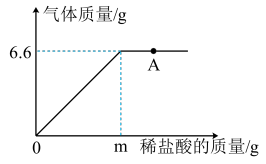
(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸___________ g。
(2)图中“A”点的溶质是___________ (填化学式)。
(3)计算该样品中CaCO3的质量分数。_________ (写出计算过程,结果精确到0.1%)

(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸
(2)图中“A”点的溶质是
(3)计算该样品中CaCO3的质量分数。
您最近一年使用:0次
解题方法
3 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
21-22高一·全国·假期作业
4 . 回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____ 。
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
5 . 某种胃药的有效成分为碳酸钙,某实验小组为测定其中碳酸钙的含量,取10粒药片(0.1 g/粒)研碎后溶解。加入25.00 mL 1.0 mol/L的稀盐酸反应,最后用1.0 mol/LNaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为___________ mL。
(2)药片中碳酸钙的质量分数为___________ 。
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(NaOH)/mL | 13.00 | 12.90 | 11.40 | 13.10 |
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 计算:
(1)agNa2S中含b个Na+,则阿伏加德罗常数为__ (用含a、b的代数式表示)
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是__ %(结果保留一位小数)
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为___ ;
②该注射液中葡萄糖的物质的量浓度为___ 。(保留两位小数)
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是___ 。(结果保留1位小数)
(1)agNa2S中含b个Na+,则阿伏加德罗常数为
(2)OH-与H2O数目之比为1:20的KOH水溶液中,溶质(KOH)的质量分数是
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
| 5%葡萄糖注射液 1000mL [性状]本品为无色或几 乎无色的透明 晶体。味甜。 [规格] 1000mL, 50g。 [贮藏]密闭保存。 |
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
③检测人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL;1mol=1000mmol)。以“mmol/L”表示时,人的血糖正常值在3.6~6.1mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
7 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
8 . I.科学研究小组的同学为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,进行了下列相关实验。其实验流程如下:
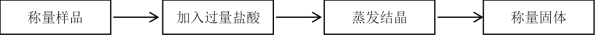
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸_______ mL。
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数_______ (保留3位有效数字)。
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数_______ 。
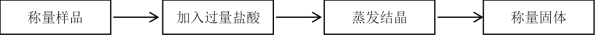
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中
 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数
您最近一年使用:0次
2021-01-27更新
|
261次组卷
|
2卷引用:山东省淄博市2020-2021学年高一上学期期末考试化学试题
9 . (1)称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,固体中铜与氧化铜的质量之比为_______。(请将结果化为小数,且保留至小数点后两位)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
(2)向1000克未知溶质质量分数的硫酸铜溶液中加入一定量的氢氧化钠溶液,过滤、干燥后得到蓝色固体19.6克。在所得滤液中加入过量铁粉,充分反应后,再加入足量盐酸,最后得到6.4克固体,求原溶液中硫酸铜的质量分数。(请写出计算过程)
您最近一年使用:0次
解题方法
10 . 化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的含量。
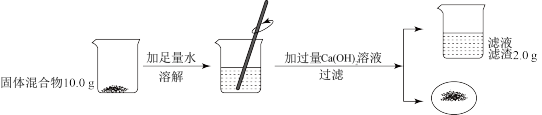
(1)根据题中信息_______ (填“能”或“不能”)计算Ca(OH)2溶液的质量分数。
(2)计算固体混合物中Na2CO3的质量_______ 。

(1)根据题中信息
(2)计算固体混合物中Na2CO3的质量
您最近一年使用:0次



