名校
解题方法
1 . 完成下列小题
(1) 溶液含中,含
溶液含中,含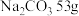 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度_____  。
。
(2)对于反应: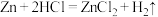 ,现有
,现有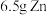 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有_____ 。
(3)对于反应: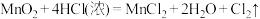 。
。
①用双线桥法表示上述反应电子转移的方向和数目_____ 。
②上述反应中还原剂是_____ ,若该反应有中有 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量_____ g,生成氯在气在STP时体积是_____ L。
③若使用浓盐酸的质量分数0.365、密度 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是_____  。
。
(1)
 溶液含中,含
溶液含中,含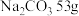 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度 。
。(2)对于反应:
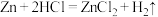 ,现有
,现有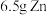 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有(3)对于反应:
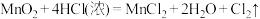 。
。①用双线桥法表示上述反应电子转移的方向和数目
②上述反应中还原剂是
 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量③若使用浓盐酸的质量分数0.365、密度
 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是 。
。
您最近一年使用:0次
解题方法
2 . 为测定某种铝镁合金中铝的质量分数,探究小组进行了实验:称取质量为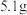 的合金,加入的稀盐酸,恰好完全反应,并产生了
的合金,加入的稀盐酸,恰好完全反应,并产生了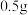 的氢气。计算铝镁合金中铝的质量分数是多少
的氢气。计算铝镁合金中铝的质量分数是多少_____ 。
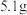 的合金,加入的稀盐酸,恰好完全反应,并产生了
的合金,加入的稀盐酸,恰好完全反应,并产生了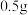 的氢气。计算铝镁合金中铝的质量分数是多少
的氢气。计算铝镁合金中铝的质量分数是多少
您最近一年使用:0次
3 . 实验室用稀盐酸和大理石(杂质不与稀盐酸反应)反应制取二氧化碳。某兴趣小组为测定该实验废液的成分,取100g废液,向其中加入溶质质量分数为20%的碳酸钠溶液,生成沉淀的质量与加入碳酸钠溶液的质量关系如图所示。

(1)当加入碳酸钠溶液的质量为53g时,所得溶液的质量为___________ g。
(2)废液中氯化氢的质量分数为___________ 。
(3)当加入159g碳酸钠溶液时,所得溶液中溶质的质量为___________ g。

(1)当加入碳酸钠溶液的质量为53g时,所得溶液的质量为
(2)废液中氯化氢的质量分数为
(3)当加入159g碳酸钠溶液时,所得溶液中溶质的质量为
您最近一年使用:0次
名校
解题方法
4 . 为测定某铝镁铜合金中铝、镁的质量分数,进行如下实验(忽略反应中水的蒸发):①向30.0g合金粉末中加入200g 30.0% NaOH溶液,充分反应后,称得固液混合物质量为227.0g。②再向混合液中加入过量稀硫酸,充分反应后剩余固体洗涤干燥后称得质量为0.6g。(计算结果保留一位小数)
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为___________ mol/L。
(2)30.0g合金中Al的质量为___________ g。
(3)合金中Mg元素的质量分数为___________ 。
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为
(2)30.0g合金中Al的质量为
(3)合金中Mg元素的质量分数为
您最近一年使用:0次
名校
5 . “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
(1)该84消毒液NaClO物质的量浓度约为_______ (保留1位小数)。
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是_______ (填字母)。
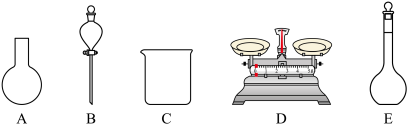
A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中_______ L的CO2(标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ ,某消毒小组人员用18.4mol·L-1的浓硫酸配制500mL2.3mol·L-1的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_______ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(1)该84消毒液NaClO物质的量浓度约为
(2)该同学参阅该84消毒液的配方,欲用NaClO固体配制480mL该种84消毒液。下列说法不正确的是

A.如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.使用前要检查容量瓶是否漏液
C.容量瓶上标有容积、温度和浓度
D.需要称量NaClO固体的质量为149.0g
E.容量瓶用蒸馏水洗净后,须烘干后再使用
(3)一瓶上述84消毒液理论上能吸收空气中
(4)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次
2023-08-26更新
|
284次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一上学期12月月考化学试题
解题方法
6 . 称取8.00g氧化铜(CuO)和氧化铁(Fe2O3)的固体混合物,加入98g质量分数20%的硫酸充分溶解。往所得溶液中加入11.20g铁粉,充分反应后得到FeSO4溶液(溶液中不含Fe3+、Cu2+)与6.08g固体。则反应后溶液中溶质FeSO4的质量为_______ g;固体混合物中氧化铜的质量为_________ g。
您最近一年使用:0次
名校
解题方法
7 . 完成下列问题。
(1)阅读、分析下列两个材料。
材料一
材料二
选择以下方法分离物质:
A.过滤法 B.冷却结晶法 C.蒸发结晶法 D.蒸馏法 E.分液法
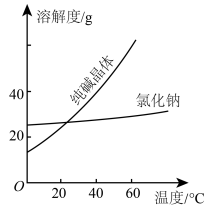
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用___________ 法。
②将乙二醇和丙三醇相互分离的最佳方法是___________ 法。
(2)取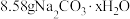 溶于水配成溶液然后逐滴滴入质量分数为
溶于水配成溶液然后逐滴滴入质量分数为 ,密度为
,密度为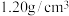 的盐酸直至没有气体放出,用去盐酸
的盐酸直至没有气体放出,用去盐酸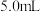 。则生成标况下
。则生成标况下 气体的体积为
气体的体积为___________ ; 的值
的值___________ 。
(3)在无土栽培中,需配制 含有
含有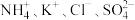 的植物培养液。且要求该培养液中
的植物培养液。且要求该培养液中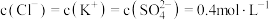 ,该培养液中,
,该培养液中,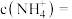
___________  。若用
。若用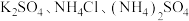 配制培养液,则需
配制培养液,则需___________  。
。
(4)硫酸镁溶液的密度是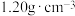 ,其中镁离子的质量分数是
,其中镁离子的质量分数是 ,硫酸镁溶液物质的量浓度是
,硫酸镁溶液物质的量浓度是___________ 。
(1)阅读、分析下列两个材料。
材料一

材料二
| 物质 | 熔点/ | 沸点/ | 密度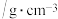 | 溶解性 |
乙二醇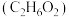 | 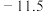 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.过滤法 B.冷却结晶法 C.蒸发结晶法 D.蒸馏法 E.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
②将乙二醇和丙三醇相互分离的最佳方法是
(2)取
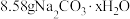 溶于水配成溶液然后逐滴滴入质量分数为
溶于水配成溶液然后逐滴滴入质量分数为 ,密度为
,密度为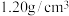 的盐酸直至没有气体放出,用去盐酸
的盐酸直至没有气体放出,用去盐酸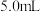 。则生成标况下
。则生成标况下 气体的体积为
气体的体积为 的值
的值(3)在无土栽培中,需配制
 含有
含有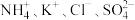 的植物培养液。且要求该培养液中
的植物培养液。且要求该培养液中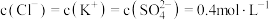 ,该培养液中,
,该培养液中,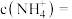
 。若用
。若用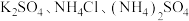 配制培养液,则需
配制培养液,则需 。
。(4)硫酸镁溶液的密度是
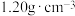 ,其中镁离子的质量分数是
,其中镁离子的质量分数是 ,硫酸镁溶液物质的量浓度是
,硫酸镁溶液物质的量浓度是
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)在标准状况下,1.7g氨气所占的体积约为_______ L,它与_______ 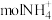 含有相同数目的电子。
含有相同数目的电子。
(2)某气态氧化物化学式为 ,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物中R的相对原子质量为
,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物中R的相对原子质量为_______ 。
(3)同温同压下, 与氦气的密度之比为
与氦气的密度之比为_______ ,若质量相同,两种气体的体积比为_______ 。
(4)在标准状况下,将A气体VL(摩尔质量是 )溶于0.5L水中,所得溶液的密度为
)溶于0.5L水中,所得溶液的密度为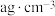 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为_______ 。
(5)现有含 和
和 的混合溶液200mL,其中
的混合溶液200mL,其中 物质的量浓度为
物质的量浓度为 ,
, 物质的量浓度为
物质的量浓度为 ,若向此溶液中加入一定量浓硫酸,使其配成
,若向此溶液中加入一定量浓硫酸,使其配成 和
和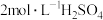 的混合溶液。请问最终所得混合溶液的体积是
的混合溶液。请问最终所得混合溶液的体积是_______ mL,需加入密度为 、质量分数为98%的浓硫酸
、质量分数为98%的浓硫酸_______ mL(保留到小数点后1位)。
(1)在标准状况下,1.7g氨气所占的体积约为
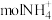 含有相同数目的电子。
含有相同数目的电子。(2)某气态氧化物化学式为
 ,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物中R的相对原子质量为
,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物中R的相对原子质量为(3)同温同压下,
 与氦气的密度之比为
与氦气的密度之比为(4)在标准状况下,将A气体VL(摩尔质量是
 )溶于0.5L水中,所得溶液的密度为
)溶于0.5L水中,所得溶液的密度为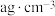 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为(5)现有含
 和
和 的混合溶液200mL,其中
的混合溶液200mL,其中 物质的量浓度为
物质的量浓度为 ,
, 物质的量浓度为
物质的量浓度为 ,若向此溶液中加入一定量浓硫酸,使其配成
,若向此溶液中加入一定量浓硫酸,使其配成 和
和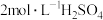 的混合溶液。请问最终所得混合溶液的体积是
的混合溶液。请问最终所得混合溶液的体积是 、质量分数为98%的浓硫酸
、质量分数为98%的浓硫酸
您最近一年使用:0次
名校
解题方法
9 . 物质的量是一个联系宏观和微观的重要物理量。请回答下列有关问题。
(1)同温同压下,A2气体与B2气体化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(2)已知 的电子数为a,M的质量数为A,则2 mol的M的中子数为
的电子数为a,M的质量数为A,则2 mol的M的中子数为___________ 。
(3)质量之比为16∶7∶6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(4)稀硫酸与铝恰好完全反应,所得V mL Al2(SO4)3溶液中含有m g Al3+,则该溶液中 物质的量浓度为
物质的量浓度为___________ mol·L-1。
(5)标准状况下,将体积比为9∶1∶4的H2、Cl2、O2在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为___________ 。(保留三位小数)
(1)同温同压下,A2气体与B2气体化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(2)已知
 的电子数为a,M的质量数为A,则2 mol的M的中子数为
的电子数为a,M的质量数为A,则2 mol的M的中子数为(3)质量之比为16∶7∶6的三种气体SO2、CO、NO。分子个数之比为
(4)稀硫酸与铝恰好完全反应,所得V mL Al2(SO4)3溶液中含有m g Al3+,则该溶液中
 物质的量浓度为
物质的量浓度为(5)标准状况下,将体积比为9∶1∶4的H2、Cl2、O2在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为
您最近一年使用:0次
10 . 完成下列问题
(1)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为___________ mol/L。
(2)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为___________ 。
(3) 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应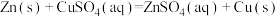 的
的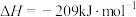 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为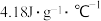 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为___________ ℃。
(1)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为
(2)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为
(3)
 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应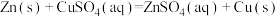 的
的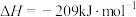 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为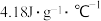 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
您最近一年使用:0次



