解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。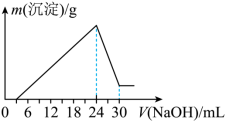
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
2 . 测定冶金级高纯硅中铁元素的含量:将mg样品用氢氟酸和硝酸溶解处理,配成V mL溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入邻二氮菲,形成橙红色物质。利用吸光度法测得吸光度为0.500(吸光度与Fe2+浓度的关系曲线如图所示)。
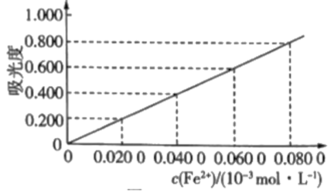
(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数表达式为___________ (用字母表示)。

(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为
(2)样品中铁元素的质量分数表达式为
您最近一年使用:0次
3 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次
名校
解题方法
4 . 三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=_____________ 。
(2)三聚氰胺分子中碳原子数为_____________ ,理由是(写出计算式)_____________ 。
(3)三聚氰胺的分子式为_____________ 。
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为______ 。
(1)分子式中原子个数比N(C)∶N(H)∶N(N)=
(2)三聚氰胺分子中碳原子数为
(3)三聚氰胺的分子式为
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
2020-07-30更新
|
546次组卷
|
4卷引用:甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题
解题方法
5 . 奶粉中蛋白质含量的国家标准是:每100g婴幼儿奶粉中含蛋白质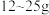 。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取
。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取 该奶粉样品进行反应后,生成的
该奶粉样品进行反应后,生成的 和
和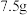 质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于
质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于________ (填“合格”或“不合格”)奶粉。
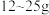 。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取
。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取 该奶粉样品进行反应后,生成的
该奶粉样品进行反应后,生成的 和
和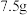 质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于
质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于
您最近一年使用:0次
6 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
2019-12-15更新
|
497次组卷
|
2卷引用:江西省山江湖协作体2019-2020学年高一上学期第三次月考(自招班)化学试题
2025高三上·全国·专题练习
解题方法
7 . 把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是___________ 。
(2)该合金中镁与铝的物质的量之比是___________ 。
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是___________ 。
(1)该合金中铝的质量分数是
(2)该合金中镁与铝的物质的量之比是
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是
您最近一年使用:0次
8 .  可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):
Ⅰ.取0.68000 g 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。
Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为___________ mol。
(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为___________ mol。
(3)产品中硫化氢的质量分数为___________ 。
 可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与
可用于光电材料,为测定某实验小组制得的产品中硫化氢的质量分数(设该产品中的其他成分不与 溶液反应):
溶液反应):Ⅰ.取0.68000 g
 产品,与足量
产品,与足量 溶液充分反应后。
溶液充分反应后。Ⅱ.将生成的CuS置于已恒重、质量为31.230 g的坩埚中煅烧,恒重后总质量为32.814 g。
请计算:
(1)实验过程中化学科研工作者使用了950 mL 0.60000 mol/L
 溶液,该试剂的物质的量为
溶液,该试剂的物质的量为(2)Ⅱ中CuS煅烧成CuO,CuO的物质的量为
(3)产品中硫化氢的质量分数为
您最近一年使用:0次
名校
9 . 向100mL含 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
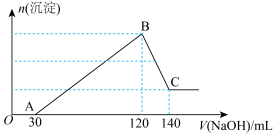
(1)写出OA段发生的离子方程式___________ ;
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为___________ :(保留一位小数)
(3)原溶液中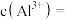
___________ ,
___________ ;
(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为 ,则x的值为多少?
,则x的值为多少?___________ (无计算过程不给分)。
 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
(1)写出OA段发生的离子方程式
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为
| 分子式:NaOH 相对分子质量:40 密度:  NaOH的质量分数:16.7% |
(3)原溶液中
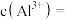

(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为
 ,则x的值为多少?
,则x的值为多少?
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
10 . 用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次



