完成下列问题
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=_______ 。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
2022高三·全国·专题练习 查看更多[1]
(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破
更新时间:2022-12-23 22:13:14
|
相似题推荐
【推荐1】某兴趣小组为确定Cu(NO3)2·xH2O的结晶水数目,称取样品5.92g,加热使其完全分解,得到1.60g黑色固体产物,同时分解产生的红棕色混合气体经冷凝得到3.2mL无色液体,无气体剩余。请计算:
(1)x=____ 。(写出计算过程,下同)
(2)无色液体的浓度为____ mol·L-1。
(1)x=
(2)无色液体的浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】请写出简单的计算过程。
(1)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2 体积为1.344 L(标准状况),则钴氧化物的化学式为_____________ 。
(2)将一定量Fe、FeO 和 Fe2O3 的混合物放入25 mL 2 mol·L-1 的HNO3溶液中,反应完全后,无固体剩余,生成 224 mL NO 气体(标准状况),再向反应后的溶液中加入1mol·L-1 的 NaOH 溶液,要使铁元素全部沉淀下来,所加 NaOH 溶液的体积最少是__________________ 。
(3)取Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300molFeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为________________ 。(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208)。
(1)在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2 体积为1.344 L(标准状况),则钴氧化物的化学式为
(2)将一定量Fe、FeO 和 Fe2O3 的混合物放入25 mL 2 mol·L-1 的HNO3溶液中,反应完全后,无固体剩余,生成 224 mL NO 气体(标准状况),再向反应后的溶液中加入1mol·L-1 的 NaOH 溶液,要使铁元素全部沉淀下来,所加 NaOH 溶液的体积最少是
(3)取Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300molFeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】有下列化合物:①NaCl②NaOH③HCl④FeCl3⑤CH3COONa⑥CH3COOH⑦NH3•H2O⑧H2O
请回答下列问题:
(1)FeCl3溶液显__________ 性,用离子方程式表示______________________ ;
CH3COOH溶液显________ 性,用离子方程式表示__________________________ ;
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)=_________________ ;
在pH=3HCl的溶液中,水电离出来的c(H+)=___________________ ;
(3)已知水存在如下平衡:H2O+H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是____________ 。
A.向水中加入NaHSO4固体
B.向水中加入(NH4)2SO4固体
C.加热至100℃[其中c(H+)=1×10-6mol•L-1]
D、向水中加Na2CO3固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则m___________ n(填“<”、“>”或“=”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va_____ Vb(填“>”、“<”、“=”、“无法确定”)
(6)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:______________________________________________ (填序号)。
(7)常温下pH=13的NaOH溶液与pH=2的盐酸溶液混合,所得混合液的pH=11,则NaOH与盐酸的体积比为________
请回答下列问题:
(1)FeCl3溶液显
CH3COOH溶液显
(2)常温下,pH=10的CH3COONa溶液中,水电离出来的c(OH-)=
在pH=3HCl的溶液中,水电离出来的c(H+)=
(3)已知水存在如下平衡:H2O+H2O
 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是A.向水中加入NaHSO4固体
B.向水中加入(NH4)2SO4固体
C.加热至100℃[其中c(H+)=1×10-6mol•L-1]
D、向水中加Na2CO3固体
(4)若等浓度、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则m
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va
(6)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:
(7)常温下pH=13的NaOH溶液与pH=2的盐酸溶液混合,所得混合液的pH=11,则NaOH与盐酸的体积比为
您最近一年使用:0次
【推荐2】(1) 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由下表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为_______ ,生成硫酸铜的物质的量为________ 。
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2 MnO(OH)2
MnO(OH)2 I2
I2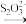 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程________ 。
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率( )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=________ 。(写出计算过程)
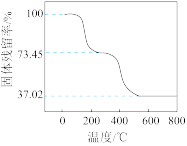
| 硫 | 氢 | Y | |
| X | 硫 | Z |
(2)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2
 MnO(OH)2
MnO(OH)2 I2
I2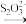 S4O
S4O
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程
(3)为确定碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(
 )随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO
)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )=
)=
您最近一年使用:0次


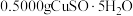 样品,加适量水溶解,转移至碘量瓶中,加过量
样品,加适量水溶解,转移至碘量瓶中,加过量 溶液并用稀
溶液并用稀 酸化,以淀粉溶液为指示剂,用
酸化,以淀粉溶液为指示剂,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 的溶液
的溶液 。测定过程中发生下列反应:
。测定过程中发生下列反应: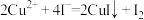 、
、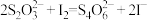 。计算
。计算 样品的纯度(写出计算过程):
样品的纯度(写出计算过程):

