2021高三·全国·专题练习
解题方法
1 . 已知CaO2在350 ℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
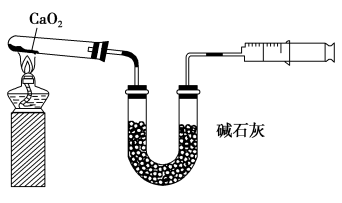
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为___________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有___________ 。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
您最近一年使用:0次
2021高三·全国·专题练习
2 . 测定三草酸合铁酸钾中铁的含量。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L—1KMnO4溶液滴定至终点。滴定终点的现象是___________ 。
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为___________ 。
(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L—1KMnO4溶液滴定至终点。滴定终点的现象是
(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
名校
3 . 粗ZnS中S含量测定可采用“碘量法”测得。称取0.210g样品置于碘量瓶中,移取25.00mL0.1000mol/L的I2溶液于其中,并加入乙酸溶液,密闭,置于暗处反应10min,有单质S析出。以淀粉为指示剂,过量的I2用0.1000mol/L的Na2S2O3溶液滴定至终点。重复实验,数据如下:
已知:I2+2 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。
计算该样品中S元素的质量分数是____ %(保留小数点后一位);写出简要的计算过程。
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.28 | 10.30 |
| 2 | 0.08 | 11.26 |
| 3 | 1.34 | 11.32 |
已知:I2+2
 =2I-+
=2I-+ ,假设杂质不参加反应。
,假设杂质不参加反应。计算该样品中S元素的质量分数是
您最近一年使用:0次
名校
4 . 市售铁强化盐中铁含量测定。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数为___________ (列出式子即可)。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O
 =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为
(2)样品中铁元素的质量分数为
您最近一年使用:0次
名校
5 . A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B相对分子质量之差为___________ 。
(2)1个B分子中应该有___________ 个氧原子。
(3)A的分子式是___________ 。
(4) B可能有的三种结构简式是___________ 、___________ 、___________ 。
(1)A、B相对分子质量之差为
(2)1个B分子中应该有
(3)A的分子式是
(4) B可能有的三种结构简式是
您最近一年使用:0次
2021-06-18更新
|
517次组卷
|
2卷引用:甘肃省天水市一中2020-2021学年高二下学期第二阶段(期中)考试化学试题
20-21高一下·浙江·阶段练习
解题方法
6 . 某种胃药的有效成分为碳酸钙,某实验小组为测定其中碳酸钙的含量,取10粒药片(0.1 g/粒)研碎后溶解。加入25.00 mL 1.0 mol/L的稀盐酸反应,最后用1.0 mol/LNaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为___________ mL。
(2)药片中碳酸钙的质量分数为___________ 。
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(NaOH)/mL | 13.00 | 12.90 | 11.40 | 13.10 |
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
7 . 过氧乙酸(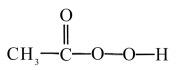 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是__________ ,所以过氧乙酸需要___________ 保存。
(2)过氧乙酸具有强氧化性,这与它的( )
)________ (填序号)键有关,向硫酸酸化的过氧乙酸溶液中加入少量KI溶液,溶液变黄,发生反应的离子方程式是_________ ,如有 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是___________ mol。
(3)过氧乙酸可由 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是_________ ,其中浓硫酸用量(浓硫酸占反应液的体积百分数)对过氧乙酸的含量的影响如图:
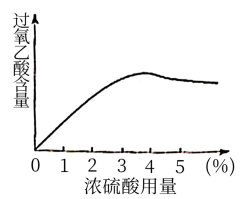
根据图表分析,浓硫酸的合适用量为___________ %(填整数)。
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
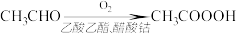
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为________ kg。
 )可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。
)可以有效地杀灭新冠肺炎等病毒,是一种广泛、高效、速效、廉价的消毒剂,应用广泛。回答下列回题。(1)过氧乙酸极不稳定,110℃时遇空气发生爆炸,此时发生反应的化学方程式是
(2)过氧乙酸具有强氧化性,这与它的(
 )
) 过氧乙酸被还原,转移电子的物质的量是
过氧乙酸被还原,转移电子的物质的量是(3)过氧乙酸可由
 与
与 ,在浓硫酸催化作用下制得,反应方程式是
,在浓硫酸催化作用下制得,反应方程式是
根据图表分析,浓硫酸的合适用量为
(4)过氧乙酸也可以用乙醛氧化法制得,反应原理为:
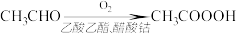
反应中乙醛的转化率为85%,生产质量分数10%的过氧乙酸溶液100kg,需要乙醛的质量为
您最近一年使用:0次
解题方法
8 . 测定冶金级高纯硅中铁元素的含量:将mg样品用氢氟酸和硝酸溶解处理,配成V mL溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入邻二氮菲,形成橙红色物质。利用吸光度法测得吸光度为0.500(吸光度与Fe2+浓度的关系曲线如图所示)。
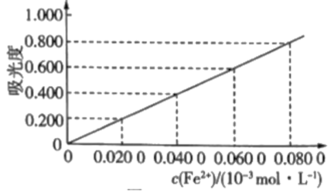
(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数表达式为___________ (用字母表示)。

(1)酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为
(2)样品中铁元素的质量分数表达式为
您最近一年使用:0次
9 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
10 . I.科学研究小组的同学为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,进行了下列相关实验。其实验流程如下:
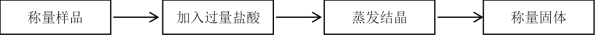
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸_______ mL。
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数_______ (保留3位有效数字)。
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数_______ 。
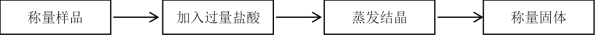
(1)该实验需要用到1.50 mol/L的稀盐酸500 mL,但实验室只有12.0 mol/L的浓盐酸。则配制稀盐酸所用浓盐酸
(2)若实验中测得样品质量为46.4 g,固体质量为40.95 g,请列式计算碳酸钠的质量分数
II.为测定某氯化亚铜样品中CuCl的含量,某同学设计如下实验:准确称取氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待固体完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液氧化反应生成的Fe2+,消耗K2Cr2O7溶液b mL,反应中
 被还原为Cr3+。请列式计算样品中CuCl的质量分数
被还原为Cr3+。请列式计算样品中CuCl的质量分数
您最近一年使用:0次
2021-01-27更新
|
261次组卷
|
2卷引用:山东省淄博市2020-2021学年高一上学期期末考试化学试题



