1 . 化学兴趣小组为测定某大理石样品中CaCO3的含量,进行如下实验:取18.0g样品置于烧杯中,向其中加入质量分数为5%的稀盐酸(样品中杂质不与盐酸反应),测得生成气体的质量与加入盐酸的质量关系如图所示,请回答下列问题。
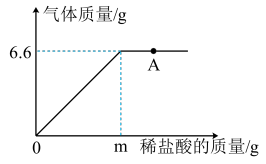
(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸___________ g。
(2)图中“A”点的溶质是___________ (填化学式)。
(3)计算该样品中CaCO3的质量分数。_________ (写出计算过程,结果精确到0.1%)

(1)实验室现有质量分数为30%的盐酸50.0g,最多可配制质量分数为5%的盐酸
(2)图中“A”点的溶质是
(3)计算该样品中CaCO3的质量分数。
您最近一年使用:0次
2023高三·全国·专题练习
2 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的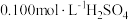 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为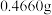 。
。
产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
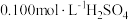 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为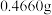 。
。产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
21-22高一·全国·假期作业
3 . 回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____ 。
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
4 . 已知CaO2在350 ℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
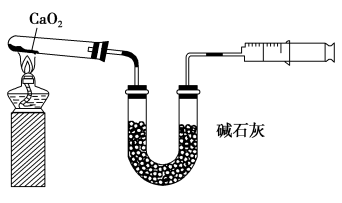
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为___________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有___________ 。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
您最近一年使用:0次
名校
5 . 现有一种铜粉和铝粉的混合物样品,为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100mL稀盐酸加入其中恰好完全反应,剩余固体2.3g。
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
(1)求该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
您最近一年使用:0次
2018-01-28更新
|
122次组卷
|
2卷引用:云南省峨山彝族自治县第一中学2017-2018学年高一上学期期末考试化学试题
9-10高二·山东·假期作业
6 . 氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平:___ MnO4-+___ H2C2O4+___ H+―___ Mn2++____ CO2↑+___ H2O
(2)0.05mol·L-1KMnO4标准溶液应置于_________ (选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为__________________________________________________ 。
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)________________ 。
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
②过滤并洗涤①所得沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
回答下列问题:
(1)配平:
(2)0.05mol·L-1KMnO4标准溶液应置于
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
7 . 质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)标准状况下,17g NH3的体积为___________ ,含有氢原子个数为___________ ,它与标准状况下___________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为___________ ,R的相对原子质量为___________ 。
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为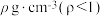 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
(6)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为___________ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为___________ mL。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为
(2)标准状况下,17g NH3的体积为
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为
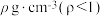 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。A.溶质的质量分数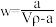 |
B.溶质的物质的量浓度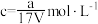 |
C.溶液密度ρ可表示为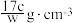 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
8 . 把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是___________ 。
(2)该合金中镁与铝的物质的量之比是___________ 。
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是___________ 。
(1)该合金中铝的质量分数是
(2)该合金中镁与铝的物质的量之比是
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是
您最近一年使用:0次
9 . 化学实验兴趣小组对当地出产的大理石中所含碳酸钙的质量分数进行了测定。取15g大理石样品放入烧杯中,再向其中加入194.4g盐酸充分反应。反应结束后称量剩余混合物的质量为205g(提示:大理石样品中的杂质不与稀盐酸反应也不溶于水;反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑),求:
(1)反应生成CO2的质量_____ 。
(2)反应后所得溶液的溶质质量分数(结果保留一位小数)_____ 。
(1)反应生成CO2的质量
(2)反应后所得溶液的溶质质量分数(结果保留一位小数)
您最近一年使用:0次
名校
解题方法
10 . 为测定某铝镁铜合金中铝、镁的质量分数,进行如下实验(忽略反应中水的蒸发):①向30.0g合金粉末中加入200g 30.0% NaOH溶液,充分反应后,称得固液混合物质量为227.0g。②再向混合液中加入过量稀硫酸,充分反应后剩余固体洗涤干燥后称得质量为0.6g。(计算结果保留一位小数)
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为___________ mol/L。
(2)30.0g合金中Al的质量为___________ g。
(3)合金中Mg元素的质量分数为___________ 。
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为
(2)30.0g合金中Al的质量为
(3)合金中Mg元素的质量分数为
您最近一年使用:0次



