测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用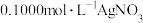 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是___________ 。
(2)晶体中KSCN的质量分数为___________ (计算结果精确至0.1%)。
 溶液作指示剂,用
溶液作指示剂,用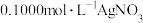 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 ,标准溶液20.00mL。
,标准溶液20.00mL。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中KSCN的质量分数为
2022高三·全国·专题练习 查看更多[1]
(已下线)专题18 无机实验计算-2022年高考化学二轮复习重点专题常考点突破练
更新时间:2022/03/12 09:44:13
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】回答下列问题。
(1)常温下,V1mLpH=1的盐酸与V2mL0.05mol•L-1Ba(OH)2溶液混合(忽略混合过程中溶液体积的变化),所得混合溶液的pH=2,则V1:V2等于___________ 。
(2)某温度下,K2CO3溶液吸收一定量的CO2后,c( ):c(
):c( )=1:2,则该溶液的pH=
)=1:2,则该溶液的pH=___________ (该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)。
(3)用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,实验测得NH4HSO3溶液中 =15,则溶液的pH为
=15,则溶液的pH为___________ (已知:该条件下H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(4)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol•L-1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀,用0.2500mol•L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL,已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4; +
+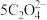 +16H+=2Mn2++10CO2↑+8H2O,则达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O,则达到滴定终点时的现象为___________ ,亚硝酰硫酸的纯度为___________ (精确到0.1%)。
(1)常温下,V1mLpH=1的盐酸与V2mL0.05mol•L-1Ba(OH)2溶液混合(忽略混合过程中溶液体积的变化),所得混合溶液的pH=2,则V1:V2等于
(2)某温度下,K2CO3溶液吸收一定量的CO2后,c(
 ):c(
):c( )=1:2,则该溶液的pH=
)=1:2,则该溶液的pH=(3)用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,实验测得NH4HSO3溶液中
 =15,则溶液的pH为
=15,则溶液的pH为(4)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol•L-1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀,用0.2500mol•L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL,已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;
 +
+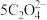 +16H+=2Mn2++10CO2↑+8H2O,则达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O,则达到滴定终点时的现象为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】可用“碘量法”测定Na2S2O5产品的纯度,其操作步骤如下:将一定质量的待测产品加入到一定体积的过量碘溶液中,发生反应Na2S2O5 +2I2+3H2O=Na2SO4+ H2SO4+4HI;充分反应后,采用Na2S2O3 标准溶液滴定上述过程中剩余的I2,发生反应2 Na2S2O3 +I2= Na2S4O6+ 2NaI,用淀粉溶液作指示剂。最后由测定的数据计算出产品中Na2S2O5 的量(假设杂质不参加反应)。若产品质量为a g。所用碘溶液的物质的量浓度为a mol·L-1、体积为V1mL,Na2S2O3 标准溶液的物质的量浓度为b mol·L-1 ,达到滴定终点时,消耗Na2S2O3标准溶液V mL,则该Na2S2O5产品的纯度为_________ (列式即可),写出计算过程。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】利用K2Cr2O7标准溶液定量测定硫代硫酸钠(Na2S2O3•5H2O)的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950mol•L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O +6I-+14H+═3I2+2Cr3++7H2O,然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I-+14H+═3I2+2Cr3++7H2O,然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O ═S4O
═S4O +2I—,加入淀粉溶液作为指示剂,继续滴定,当滴入最后半滴Na2S2O3溶液,溶液
+2I—,加入淀粉溶液作为指示剂,继续滴定,当滴入最后半滴Na2S2O3溶液,溶液___________ ,即为终点,平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为___________ %(保留1位小数)。
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950mol•L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O
 +6I-+14H+═3I2+2Cr3++7H2O,然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
+6I-+14H+═3I2+2Cr3++7H2O,然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O ═S4O
═S4O +2I—,加入淀粉溶液作为指示剂,继续滴定,当滴入最后半滴Na2S2O3溶液,溶液
+2I—,加入淀粉溶液作为指示剂,继续滴定,当滴入最后半滴Na2S2O3溶液,溶液
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】黄铁矾法是硫酸体系中除铁的常用方法,黄铵铁矾是黄铁矾中的一种[化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。
(1) 除去MnSO4酸性溶液中的Fe2+可向溶液中加入MnO2,充分搅拌,然后用氨水调节溶液的pH为1~3,升温到95 ℃,静置即可形成黄铵铁矾沉淀。MnO2氧化Fe2+的离子方程式为_______________________ ,静置形成黄铵铁矾过程中溶液的pH________ (填“增大”“减小”或“不变”)。
(2) 依据下列实验和数据可确定黄铵铁矾的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3·H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
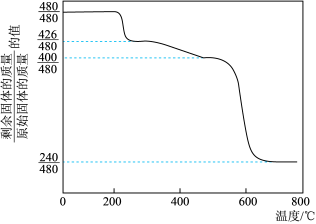
根据以上实验及图中数据确定黄铵铁矾的化学式______________ (写出计算过程)。
(1) 除去MnSO4酸性溶液中的Fe2+可向溶液中加入MnO2,充分搅拌,然后用氨水调节溶液的pH为1~3,升温到95 ℃,静置即可形成黄铵铁矾沉淀。MnO2氧化Fe2+的离子方程式为
(2) 依据下列实验和数据可确定黄铵铁矾的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3·H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。

根据以上实验及图中数据确定黄铵铁矾的化学式
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】(一)现有浓度均为 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中 分别为
分别为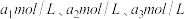 ,则它们的大小关系为
,则它们的大小关系为_________________________________________ 。
(2)等体积的以上三种酸分别与过量的 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为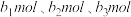 ,则它们的大小关系为
,则它们的大小关系为__________________________ 。
(3)分别用以上三种酸中和一定量的 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为 ,其大小关系为
,其大小关系为__________________________________ 。
(4)分别与锌反应,开始时生成氢气的速率为 ,其大小关系为
,其大小关系为______________________ 。
(二)有 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
已知:① 溶液的
溶液的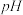 均大于7,
均大于7,  的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;② 溶液和
溶液和 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀,  溶液和
溶液和 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体,  溶液和
溶液和 溶液混合时无现象。
溶液混合时无现象。
(1) 是
是_________________________ , 是
是_______________________ (填化学式)。
(2)写出 和
和 反应的离子方程式
反应的离子方程式_________________________________ 。
(3)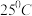 时,
时, 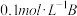 溶液的
溶液的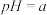 ,则
,则 溶液中
溶液中
_________________________________________ (用含有 的关系式表示)。
的关系式表示)。
(4)将等体积、等物质的量浓度的 溶液和
溶液和 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________ 。
(5)在一定体积的 的
的 溶液中,加入一定体积的
溶液中,加入一定体积的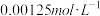 的盐酸,混合溶液的
的盐酸,混合溶液的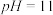 ,若反应后溶液的体积等于
,若反应后溶液的体积等于 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则 溶液与盐酸的体积比是
溶液与盐酸的体积比是_______________ 。
 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:(1)若三种溶液中
 分别为
分别为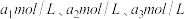 ,则它们的大小关系为
,则它们的大小关系为(2)等体积的以上三种酸分别与过量的
 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为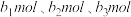 ,则它们的大小关系为
,则它们的大小关系为(3)分别用以上三种酸中和一定量的
 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为 ,其大小关系为
,其大小关系为(4)分别与锌反应,开始时生成氢气的速率为
 ,其大小关系为
,其大小关系为(二)有
 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。| 阳离子 | 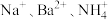 |
| 阴离子 | 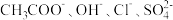 |
已知:①
 溶液的
溶液的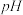 均大于7,
均大于7,  的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;② 溶液和
溶液和 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀,  溶液和
溶液和 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体,  溶液和
溶液和 溶液混合时无现象。
溶液混合时无现象。(1)
 是
是 是
是(2)写出
 和
和 反应的离子方程式
反应的离子方程式(3)
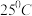 时,
时, 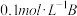 溶液的
溶液的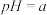 ,则
,则 溶液中
溶液中
 的关系式表示)。
的关系式表示)。(4)将等体积、等物质的量浓度的
 溶液和
溶液和 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是(5)在一定体积的
 的
的 溶液中,加入一定体积的
溶液中,加入一定体积的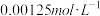 的盐酸,混合溶液的
的盐酸,混合溶液的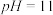 ,若反应后溶液的体积等于
,若反应后溶液的体积等于 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则 溶液与盐酸的体积比是
溶液与盐酸的体积比是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】测定产品纯度
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
称取1.5000g某硫代硫酸钠晶体样品溶于水配成100.00mL溶液,取0.00900mol∙L−1的K2Cr2O7标准溶液25.00mL,硫酸酸化后加入过量KI,发生反应: +6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2
+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2 =
= +2I-。加入淀粉溶液作为指示剂,继续滴定至终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-。加入淀粉溶液作为指示剂,继续滴定至终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___________ %(保留1位小数)。
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
称取1.5000g某硫代硫酸钠晶体样品溶于水配成100.00mL溶液,取0.00900mol∙L−1的K2Cr2O7标准溶液25.00mL,硫酸酸化后加入过量KI,发生反应:
 +6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2
+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2 =
= +2I-。加入淀粉溶液作为指示剂,继续滴定至终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-。加入淀粉溶液作为指示剂,继续滴定至终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】黄铁矿主要成分是二硫化亚铁。某化学实验小组取1.0g黄铁矿样品在空气中充分灼烧时发生反应4FeS2+11O2 2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
(1)FeS2在空气中灼烧时,化合价升高的元素是__________ ,SO2与Fe2(SO4)3反应的化学方程式是_________________ 。
(2)原Fe2(SO4)3溶液的物质的量浓度为_______ ,黄铁矿中FeS2的质量分数为______ 。
(3)工业上煅烧10 t上述黄铁矿,产生的SO2经催化氧化制硫酸,理论上可制得98%的浓硫酸多少吨______ ?(列式计算)
 2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:(1)FeS2在空气中灼烧时,化合价升高的元素是
(2)原Fe2(SO4)3溶液的物质的量浓度为
(3)工业上煅烧10 t上述黄铁矿,产生的SO2经催化氧化制硫酸,理论上可制得98%的浓硫酸多少吨
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3=NaCl+___________ +CO2↑。
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和___________ 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
试分析计算下列问题:
①第一次实验时,所加 NaHCO3溶液中溶质质量是_______ 克?
②该品牌洁厕灵中HCl的质量分数是________ ?

(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3=NaCl+
(2)配制一定溶质质量分数的NaHCO3溶液,需要用到的玻璃仪器有烧杯、滴管和
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入NaHCO3溶液的质量/g | 40 | 40 | 40 | 40 | 40 |
| 反应后溶液的总质量/g | 138.9 | 177.8 | 216.7 | 255.6 | 295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO3溶液中溶质质量是
②该品牌洁厕灵中HCl的质量分数是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
I.取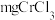 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是防止指示剂提前变色),使 转化为
转化为 ;
;
III.用新配制的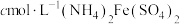 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
(1)产品中 的质量分数表达式为
的质量分数表达式为___________________________  (用含m、c、V的代数式表示)。
(用含m、c、V的代数式表示)。
(2)下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是_______________ (填标号)。
a.步骤I中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤III中所用 溶液已变质
溶液已变质
d.步骤III中读数时,滴定前俯视,滴定后平视
 质量分数的实验步骤如下:
质量分数的实验步骤如下:I.取
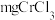 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是防止指示剂提前变色),使
 转化为
转化为 ;
;III.用新配制的
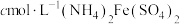 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。(1)产品中
 的质量分数表达式为
的质量分数表达式为 (用含m、c、V的代数式表示)。
(用含m、c、V的代数式表示)。(2)下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是a.步骤I中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤III中所用
 溶液已变质
溶液已变质d.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次



