名校
解题方法
1 . 某研究性学习小组类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他们对钠在CO2气体中燃烧进行了下列实验:
(1)若用下图装置制备CO2,则发生装置中反应的离子方程式为_________ 。

(2)将制得的CO2净化、干燥后由a口缓缓通入下图装置,待装置中的空气排净后点燃酒精灯,观察到玻璃直管中的钠燃烧,火焰为黄色。待冷却后,管壁附有黑色颗粒和白色物质。

①能说明装置中空气已经排净的现象是_________ 。
②若未排尽空气就开始加热,则可能发生的化学反应方程式主要为_________ 。
(3)若钠着火,可以选用的灭火物质是_________ 。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(4)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是_________ 。
(5)为确定该白色物质的成分,该小组进行了如下实验:
①通过对上述实验的分析,你认为上述三个假设中,___ 成立(填序号)。
②由实验得出:钠在CO2中燃烧的化学方程式为_____ ;每生成1mol氧化产物,转移的电子数为____ 。
(6)在实验(2)中还可能产生另一种尾气,该气体为________ ;处理该尾气的方法为_____ 。
(1)若用下图装置制备CO2,则发生装置中反应的离子方程式为

(2)将制得的CO2净化、干燥后由a口缓缓通入下图装置,待装置中的空气排净后点燃酒精灯,观察到玻璃直管中的钠燃烧,火焰为黄色。待冷却后,管壁附有黑色颗粒和白色物质。

①能说明装置中空气已经排净的现象是
②若未排尽空气就开始加热,则可能发生的化学反应方程式主要为
(3)若钠着火,可以选用的灭火物质是
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(4)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是
(5)为确定该白色物质的成分,该小组进行了如下实验:
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,
②由实验得出:钠在CO2中燃烧的化学方程式为
(6)在实验(2)中还可能产生另一种尾气,该气体为
您最近一年使用:0次
名校
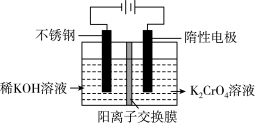
2 . 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾为原料,采用电化学制备重铬酸钾。制备装置如下图所示:
制备原理:2CrO (黄色)+2H+⇌Cr2O
(黄色)+2H+⇌Cr2O (橙色)+H2O
(橙色)+H2O
(1)通电后阳极室产生的现象为_____________ ,电极反应式是__________ 。
(2)该制备过程总反应的离子方程式可表示为4CrO +4H2O=2Cr2O
+4H2O=2Cr2O +4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
+4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为________ ;该过程中反应转移的电子数目为___________ ;此时阳极室与阴极室溶液质量变化之差(△m阴极室-△m 阳极室)为____ g。

制备原理:2CrO
 (黄色)+2H+⇌Cr2O
(黄色)+2H+⇌Cr2O (橙色)+H2O
(橙色)+H2O(1)通电后阳极室产生的现象为
(2)该制备过程总反应的离子方程式可表示为4CrO
 +4H2O=2Cr2O
+4H2O=2Cr2O +4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
+4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
3 . 制备氮化镁的装置示意图:
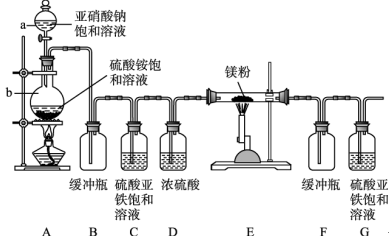
回答下列问题:
(1)填写下列仪器名称: 的名称是
的名称是_________ 。
(2)写出 中
中 和
和 反应制备氮气的离子反应方程式
反应制备氮气的离子反应方程式__________ 。
(3) 的作用是
的作用是_____ ,是否可以把 和
和 的位置对调并说明理由
的位置对调并说明理由_________ 。
(4)写出 中发生反应的化学方程式
中发生反应的化学方程式___________ 。
(5)请用化学方法检验产物中是否含有未反应的镁,写出实验操作、现象、结论_________ 。

回答下列问题:
(1)填写下列仪器名称:
 的名称是
的名称是(2)写出
 中
中 和
和 反应制备氮气的离子反应方程式
反应制备氮气的离子反应方程式(3)
 的作用是
的作用是 和
和 的位置对调并说明理由
的位置对调并说明理由(4)写出
 中发生反应的化学方程式
中发生反应的化学方程式(5)请用化学方法检验产物中是否含有未反应的镁,写出实验操作、现象、结论
您最近一年使用:0次
4 . 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
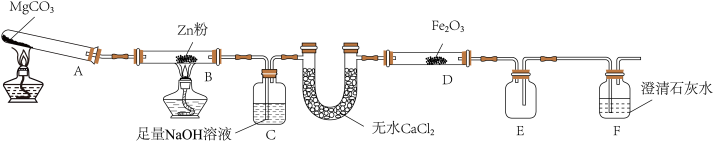
(1)图中盛无水CaCl2的仪器名称为______ 装置B中的化学反应方程式为_______ 。
(2)装置C中发生反应的离子方程式为_________ ,处理尾气的方法为________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末成分是________ 。
②根据甲组实验现象写出甲组步骤1中反应的离子方式__________ 。
③乙组步骤4中,溶液变红的原因为________ ,溶液褪色可能的原因________ 及其验证方法为________ 。

(1)图中盛无水CaCl2的仪器名称为
(2)装置C中发生反应的离子方程式为
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末成分是
②根据甲组实验现象写出甲组步骤1中反应的离子方式
③乙组步骤4中,溶液变红的原因为
您最近一年使用:0次
2024高三下·全国·专题练习
5 .  作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、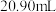 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为_______ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: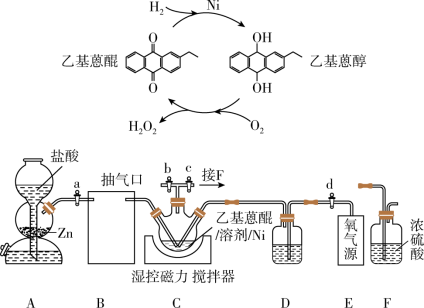
 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、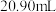 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为
您最近一年使用:0次
名校
解题方法
6 . 电化学广泛应用于工业生产和环境保护上。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
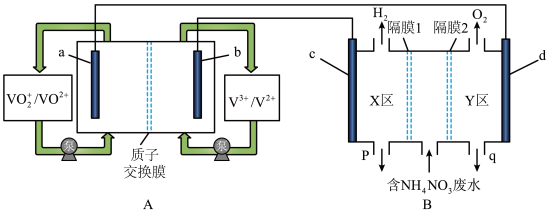
①全钒液流电池放电时,a电极反应式为___________ ,电子的流向由___________ (填“a→导线→d”或“d→导线→a”)。
②隔膜1为___________ 离子交换膜(填“阴”或“阳”),装置B中q口流出液中主要的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
③当装置A中有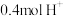 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为___________ L(标准状况下),处理___________ 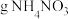 。
。
(2)用电解法可除去硝酸工业产生的尾气NO,并得到 ,工作原理如下图。
,工作原理如下图。
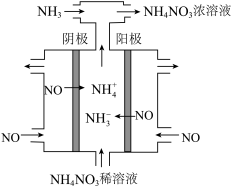
理论上通入 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为___________ 。
(1)全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长。利用该电池电解处理含
 的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
的废水制备硝酸和氨水的原理如图所示,a、b、c、d电极均为惰性电极。
①全钒液流电池放电时,a电极反应式为
②隔膜1为
③当装置A中有
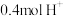 通过质子交换膜时,则装置B中产生气体的总体积为
通过质子交换膜时,则装置B中产生气体的总体积为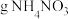 。
。(2)用电解法可除去硝酸工业产生的尾气NO,并得到
 ,工作原理如下图。
,工作原理如下图。
理论上通入
 与NO的最佳物质的量之比为
与NO的最佳物质的量之比为
您最近一年使用:0次
名校
解题方法
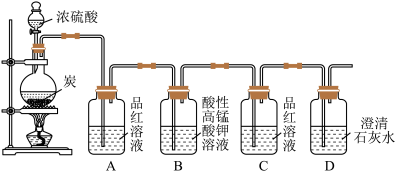
7 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:河北省唐山市丰润车轴山中学2019—2020学年高一上学期12月月考化学试题
8 . “84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
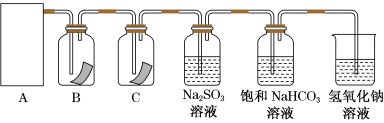
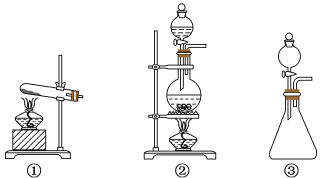
(1)从①、②、③装置中选择合适的制氯气装置(A处)____ (填标号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___ ;说明该装置存在明显的缺陷,请提出合理的改进的方法_____ 。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:____ 。检验SO42-的方法是取少量反应后溶液于试管中,先加入足量的___ 至无明显现象,然后再加入少量___ 溶液,有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有____ (填“盐酸”或“次氯酸”)。
 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-,写出氯气与Na2SO3溶液反应的离子方程式:
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有
您最近一年使用:0次
解题方法
9 . 固体化合物 X 由 3 种元素组成。某学习小组进行了如下实验:
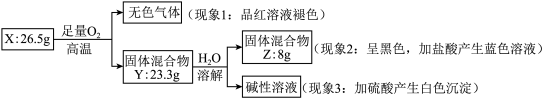
请回答:
(1)由现象 1 得出化合物 X 含有_____________ 元素(填元素符号),X 的化学式_____________ 。
(2)固体混合物 Y 的成分_____________ (填化学式)。
(3)实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是_____________ 。

请回答:
(1)由现象 1 得出化合物 X 含有
(2)固体混合物 Y 的成分
(3)实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是
您最近一年使用:0次
名校
10 . H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
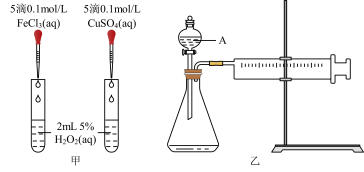
(1)若利用图甲装置,可通过观察__________ 现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________ 。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________ 。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________ ,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________ 。
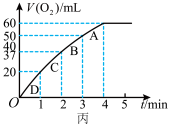
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________ 。H2O2初始物质的量浓度为_______ (保留两位小数)。

(1)若利用图甲装置,可通过观察
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:

您最近一年使用:0次
2019-09-20更新
|
445次组卷
|
10卷引用:云南省盈江县一中2019-2020学年高二上学期开学考试化学试题
云南省盈江县一中2019-2020学年高二上学期开学考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷2020年人教版高中化学必修2第二章《化学反应与能量》测试卷12020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)云南省普洱市第一中学2021-2022学年高一下学期3月份考试化学试题云南省石屏县第一中学2021-2022学年高一下学期3月份考试化学试题云南省广南县第一中学校2021-2022学年高一下学期3月份考试化学试题



