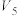1 . 乙烯是石油化学工业重要的基本原料,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。例如可以合成聚氯乙烯(PVC)和用作汽油抗震剂的CH3CH2Cl。_______ 。
(2)B→D的反应类型是_______ 。
(3)E的结构简式是_______ 。
(4)M→ 的反应方程式是
的反应方程式是_______ 。
(2)B→D的反应类型是
(3)E的结构简式是
(4)M→
 的反应方程式是
的反应方程式是
您最近一年使用:0次
2 . 工业上用 为原料制
为原料制 可简化为如下两步反应:
可简化为如下两步反应:
第一步: (条件略);第二步:
(条件略);第二步: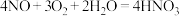 。
。
某同学用 与足量
与足量 和水为原料,在一定条件下模拟了上述生产过程,共消耗了标准状况下氨气
和水为原料,在一定条件下模拟了上述生产过程,共消耗了标准状况下氨气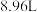 。请计算:
。请计算:
(1)消耗的 的物质的量为
的物质的量为___________ 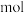 。
。
(2)整个过程转移电子的物质的量为___________ 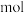 。
。
(3)理论上可获得质量分数为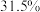 的硝酸(假设溶质不挥发)质量为
的硝酸(假设溶质不挥发)质量为___________  。
。
 为原料制
为原料制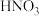 可简化为如下两步反应:
可简化为如下两步反应:第一步:
 (条件略);第二步:
(条件略);第二步: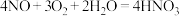 。
。某同学用
 与足量
与足量 和水为原料,在一定条件下模拟了上述生产过程,共消耗了标准状况下氨气
和水为原料,在一定条件下模拟了上述生产过程,共消耗了标准状况下氨气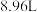 。请计算:
。请计算:(1)消耗的
 的物质的量为
的物质的量为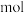 。
。(2)整个过程转移电子的物质的量为
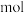 。
。(3)理论上可获得质量分数为
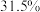 的硝酸(假设溶质不挥发)质量为
的硝酸(假设溶质不挥发)质量为 。
。
您最近一年使用:0次
解题方法
3 . 以一氧化碳和水为原料制取氢气的反应为 。
。
在10L密闭容器中,进行了以下实验,数据如下:
回答下列问题:
(1)实验①,反应达到平衡时的平均反应速率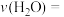
______________ 。
(2)实验②中b为_____________ 。
(3)表中
_______ 20(填“>”、“=”或“<”),解释原因___________ 。
(4)能说明上述反应已达到平衡状态的是______________(填字母标号)。
(5)若实验①达到平衡时放出16.4kJ热量,则实验②达到平衡时吸收_____________ kJ热量。
(6)若实验③在700℃下反应,其他条件不变,达到平衡时氢气的体积分数____________ 25%(填“大于”、“等于”或“小于”)。
 。
。在10L密闭容器中,进行了以下实验,数据如下:
实验 编号 | 温度/℃ | 起始时反应物的浓度/ | 平衡时某些物质的浓度/ | 达到平衡的时间/min | ||||
CO |
|
|
|
|
| |||
① | 1200 | 0.01 | 0.01 | 0 | 0 | 0.004 | a | 20 |
② | 1200 | 0 | 0 | 0.01 | 0.012 | 0.0035 | b |
|
③ | 800 | 0.01 | 0.01 | 0 | 0 | 0.005 | 0.005 |
|
(1)实验①,反应达到平衡时的平均反应速率
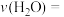
(2)实验②中b为
(3)表中

(4)能说明上述反应已达到平衡状态的是______________(填字母标号)。
| A.反应混合物中各组分的百分组成不再改变 |
| B.容器内混合气体的平均相对分子质量保持不变 |
C.消耗 的速率与生成 的速率与生成 速率相等 速率相等 |
| D.2mol O-H键断裂的同时有2mol C=O断裂 |
(6)若实验③在700℃下反应,其他条件不变,达到平衡时氢气的体积分数
您最近一年使用:0次
4 . 化合物Z是合成抗多发性骨髓瘤药物帕比司他的重要中间体,可由下列转化制得。
(1)X的分子式是_______ 。
(2)Y中含氧官能团的名称是羟基和_______ 。
(3)Y→Z反应的反应类型是_______ 。
(4)乙醛与 反应的化学方程式是
反应的化学方程式是_______ 。

(1)X的分子式是
(2)Y中含氧官能团的名称是羟基和
(3)Y→Z反应的反应类型是
(4)乙醛与
 反应的化学方程式是
反应的化学方程式是
您最近一年使用:0次
5 . 牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:___________ 。
(2)乳酸发生下列变化:___________ ,b____________ (写化学式);c的反应条件_______________ 。
(3)请写出下列反应的化学方程式,并注明反应类型。乳酸与乙醇的反应:____________ ,反应类型:_____________ 。
(4)在浓硫酸作用下,两分子乳酸相互反应生成六元环状结构的物质,写出此生成物的结构简式:__________ 。
 。完成下列问题:
。完成下列问题:(1)写出乳酸分子中官能团的名称:
(2)乳酸发生下列变化:

(3)请写出下列反应的化学方程式,并注明反应类型。乳酸与乙醇的反应:
(4)在浓硫酸作用下,两分子乳酸相互反应生成六元环状结构的物质,写出此生成物的结构简式:
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)在2L密闭容器、800℃时的反应: 体系中,
体系中,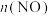 随时间的变化如下表:
随时间的变化如下表:
①如图中A点处,v(正)____________ v(逆)(填“大于”、“小于”或“等于”)。 的变化的曲线是
的变化的曲线是____________ ,用 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=_________ 。
③下列能使该反应的反应速率增大的是____________ 。
a.及时分离出 气体 b.适当升高温度 c.增大
气体 b.适当升高温度 c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂
(2)某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL 0.001
 溶液中分别加入不同浓度的草酸(
溶液中分别加入不同浓度的草酸( )溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001
)溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001
 溶液,实验结果如图2,回答有关问题:
溶液,实验结果如图2,回答有关问题:______________ 。
②由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间____________ (填“变大”、“变小”或“不变”)。
③对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行,溶液的体积单位为mL):
请完成此实验设计:
_________ ,
__________ 。设计A号试管实验的目的是_____________ 。
(1)在2L密闭容器、800℃时的反应:
 体系中,
体系中,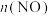 随时间的变化如下表:
随时间的变化如下表:时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

 的变化的曲线是
的变化的曲线是 表示从0~2s内该反应的平均速率v=
表示从0~2s内该反应的平均速率v=③下列能使该反应的反应速率增大的是
a.及时分离出
 气体 b.适当升高温度 c.增大
气体 b.适当升高温度 c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂(2)某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL 0.001

 溶液中分别加入不同浓度的草酸(
溶液中分别加入不同浓度的草酸( )溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001
)溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001
 溶液,实验结果如图2,回答有关问题:
溶液,实验结果如图2,回答有关问题: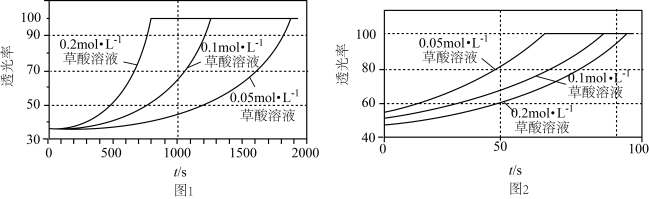
②由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间
③对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行,溶液的体积单位为mL):
试管编号 | 0.01  溶液 溶液 | 0.2  溶液 溶液 | 蒸馏水 | 2.0  溶液 溶液 |
A | 4.0 | 2.0 | 2.0 | 0 |
B |
|
| 1.5 |
|
C |
| 2.0 |
| 1.0 |
D |
| 2.0 | 0 | 2.0 |

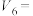
您最近一年使用:0次
7 . 已知CaF2的熔点为1402℃,可作电冶金的助熔剂。CaF2的晶胞图以及晶胞的投影图(晶胞所有面的投影均相同)。
(1)下列说法正确的是______ 。(不定项)
(2)已知CaF2的晶胞边长为5.4626×10-10m。则萤石的密度为______ g•cm-3。(保留两位小数)
(1)下列说法正确的是

| A.CaF2属于共价晶体 | B.晶胞中有4个Ca2+ |
| C.与Ca2+最近的F-有8个 | D.与F-最近的Ca2+有6个 |
(2)已知CaF2的晶胞边长为5.4626×10-10m。则萤石的密度为
您最近一年使用:0次
8 . 铜的配合物在自然界中广泛存在,请回答下列问题:
(1)硫酸铜溶液中存在多种微粒,硫酸铜溶液呈蓝色的原因是其中存在配离子_______ (填化学式),配体中提供孤电子对的原子是_______ (填元素符号)。
(2)同学甲设计如下制备铜的配合物的实验:
①结合化学用语,用平衡移动原理解释试管c中浑浊液转变为深蓝色溶液的原因_______ 。
②由上述实验可得出以下结论:
结论1:配合物的形成与_______ 、_______ 有关;
结论2:结合实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:_______ >_______ (填化学式)。
③实验结束后,向c试管中加入乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体[Cu(NH3)4]SO4·H2O,解释析出晶体的原因:_______ 。
(1)硫酸铜溶液中存在多种微粒,硫酸铜溶液呈蓝色的原因是其中存在配离子
(2)同学甲设计如下制备铜的配合物的实验:

①结合化学用语,用平衡移动原理解释试管c中浑浊液转变为深蓝色溶液的原因
②由上述实验可得出以下结论:
结论1:配合物的形成与
结论2:结合实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:
③实验结束后,向c试管中加入乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体[Cu(NH3)4]SO4·H2O,解释析出晶体的原因:
您最近一年使用:0次
名校
9 . 化学电池的发明,是贮能和供能技术的巨大进步。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应___________ 。
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为 。放电时,正极的电极反应是
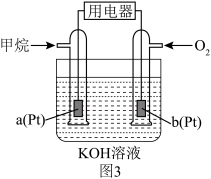
。放电时,正极的电极反应是___________ ,当外电路通过0.5mol电子时,理论上负极板的质量增加___________ g。 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为___________ 。___________ 。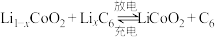 (x<1)。已知A为石墨
(x<1)。已知A为石墨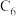 电极,则下图所示是
电极,则下图所示是___________ (填“充电”或“放电”)过程,B电极上的反应为___________ 。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为
 。放电时,正极的电极反应是
。放电时,正极的电极反应是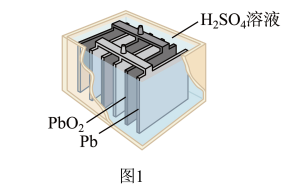
 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为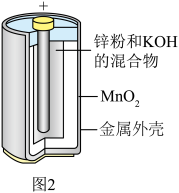
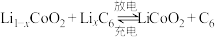 (x<1)。已知A为石墨
(x<1)。已知A为石墨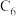 电极,则下图所示是
电极,则下图所示是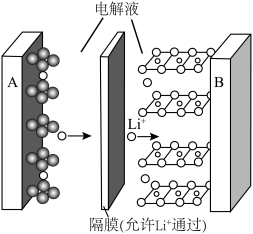
您最近一年使用:0次
名校
10 . 如图是某烃A的分子结构模型。回答下列问题:___________ 。
(2)A与溴的四氯化碳溶液反应的化学方程式是___________ 。
(3)写出A的属于烯烃的所有同分异构体的结构简式(包括顺反异构)___________ 。
(4)A在一定条件下可以发生加聚反应,其化学反应方程式是___________ 。
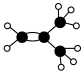
(2)A与溴的四氯化碳溶液反应的化学方程式是
(3)写出A的属于烯烃的所有同分异构体的结构简式(包括顺反异构)
(4)A在一定条件下可以发生加聚反应,其化学反应方程式是
您最近一年使用:0次