名校
1 . 回答下列问题
I、2021年4月13日,日本政府召开相关阁僚会议,正式决定向海洋排放福岛第一核电站含有对海洋环境有害的核废水,并将核废水主要辐射物质“氚(T)”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。___________ 。
A.卡通形象中标“+”号的小球表示质子
B.氚的核素符号为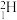
C.氚和及其同位素性质不完全相同
(2)有关 和
和 的说法正确的是___________。
的说法正确的是___________。
(3)已知天然氢元素中:氕的丰度为 ,氘的丰度为
,氘的丰度为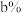 ,氚的丰度为
,氚的丰度为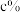 ;氕、氘、氚原子的实际质量分别用
;氕、氘、氚原子的实际质量分别用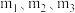 表示,
表示,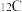 原子的质量用
原子的质量用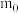 表示。则氢元素的相对原子质量计算表达式为
表示。则氢元素的相对原子质量计算表达式为___________ 。
(4)在离子 中,电子数、质子数和中子数之比为
中,电子数、质子数和中子数之比为___________ 。
II、硼氢化钠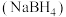 是有机合成中常用的还原剂
是有机合成中常用的还原剂
(5)硼氢化钠中存在的化学键为___________ (填标号)。
a.离子键 b.氢键 c.共价键 d.配位键
(6)已知 的第一电离能大于B的第一电离能,原因为
的第一电离能大于B的第一电离能,原因为___________ 。
(7)___________  的还原能力与标准状况下
的还原能力与标准状况下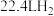 的还原能力相当(已知电负性:
的还原能力相当(已知电负性: ;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
I、2021年4月13日,日本政府召开相关阁僚会议,正式决定向海洋排放福岛第一核电站含有对海洋环境有害的核废水,并将核废水主要辐射物质“氚(T)”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。

A.卡通形象中标“+”号的小球表示质子
B.氚的核素符号为
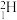
C.氚和及其同位素性质不完全相同
(2)有关
 和
和 的说法正确的是___________。
的说法正确的是___________。| A.互为同位素 | B.互为同素异形体 |
| C.电子数不同 | D.同温同压下密度之比为 |
 ,氘的丰度为
,氘的丰度为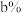 ,氚的丰度为
,氚的丰度为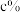 ;氕、氘、氚原子的实际质量分别用
;氕、氘、氚原子的实际质量分别用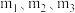 表示,
表示,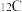 原子的质量用
原子的质量用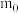 表示。则氢元素的相对原子质量计算表达式为
表示。则氢元素的相对原子质量计算表达式为(4)在离子
 中,电子数、质子数和中子数之比为
中,电子数、质子数和中子数之比为II、硼氢化钠
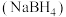 是有机合成中常用的还原剂
是有机合成中常用的还原剂(5)硼氢化钠中存在的化学键为
a.离子键 b.氢键 c.共价键 d.配位键
(6)已知
 的第一电离能大于B的第一电离能,原因为
的第一电离能大于B的第一电离能,原因为(7)
 的还原能力与标准状况下
的还原能力与标准状况下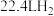 的还原能力相当(已知电负性:
的还原能力相当(已知电负性: ;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
您最近一年使用:0次
名校
2 . 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则 △H=
△H=_______ kJ∙mol-1。
(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
①E的大小对该反应的反应热_______ (填“有”或“无”)影响。
②SO2氧化为SO3的热化学方程式为_______ 。
(3)已知: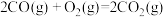 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①
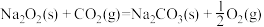 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为_______ 。
(4)常压下,某铝热反应的温度与能量变化如图所示: △H=
△H=_______ kJ∙mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为_______ 。
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则
 △H=
△H=(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
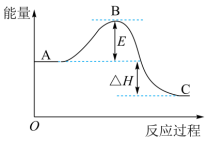
①E的大小对该反应的反应热
②SO2氧化为SO3的热化学方程式为
(3)已知:
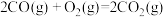 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①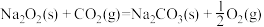 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)常压下,某铝热反应的温度与能量变化如图所示:
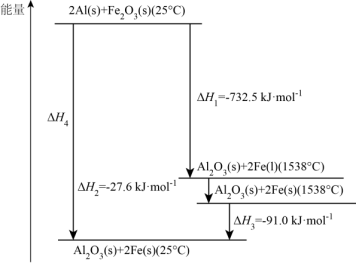
 △H=
△H=②101.3kPa、25℃时,该铝热反应的热化学方程式为
您最近一年使用:0次
3 . 硒(Se)是动物和人体所必需的微量元素,硒单质是一种重要的工业原料。
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,___________ 。
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为___________ 。
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,___________ ,___________ ,得电子能力Br大于Se.
(4)依据元素周期律,下列推断正确的是___________ (填字母)。
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,
(4)依据元素周期律,下列推断正确的是
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
您最近一年使用:0次
名校
4 . 在 密闭容器中,800℃时,反应
密闭容器中,800℃时,反应 体系中,
体系中, 随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
(1) 用
用 表示的化学反应速率
表示的化学反应速率
_______ 。从表中可以看出,该反应化学反应速率逐渐减慢,原因是_______ 。
(2)图中 点处反应
点处反应_______ (填“已达到”或“未达到”)平衡状态,A点处v(正)_______ (填“>”或“<”)v(逆)。
(3)若要加快该反应速率,可以采取的措施是_______ (任写两点)。
(4)下列能够说明反应已达到平衡状态的是_______(填字母)。
(5)已知该反应为放热反应,若生成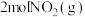 放出热量为
放出热量为 ,则通入
,则通入 与足量
与足量 充分反应生成
充分反应生成 放出的热量
放出的热量_______ (填“>”“<”或“=”)Q。
 密闭容器中,800℃时,反应
密闭容器中,800℃时,反应 体系中,
体系中,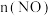 随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。时间 | 0 | 1 | 2 | 3 | 4 | 5 |
 | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
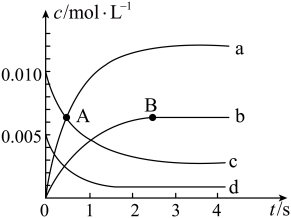
(1)
 用
用 表示的化学反应速率
表示的化学反应速率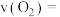
(2)图中
 点处反应
点处反应(3)若要加快该反应速率,可以采取的措施是
(4)下列能够说明反应已达到平衡状态的是_______(填字母)。
| A.混合气体的颜色不再变化 | B.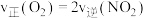 |
| C.混合气体平均摩尔质量保持不变 | D. 发生反应同时生成 发生反应同时生成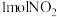 |
(5)已知该反应为放热反应,若生成
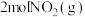 放出热量为
放出热量为 ,则通入
,则通入 与足量
与足量 充分反应生成
充分反应生成 放出的热量
放出的热量
您最近一年使用:0次
名校
5 . 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为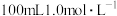 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。
(1)反应过程中能量转化的主要形式:甲为_______ ;乙为_______ 。
(2)以下叙述中,正确的是_______(填字母)。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为_______ (填“正极”或“负极”,下同), 离子移向
离子移向_______ , 电极的电极反应式为
电极的电极反应式为_______ ,当外电路中转移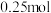 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为_______ (保留三位小数)。
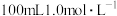 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。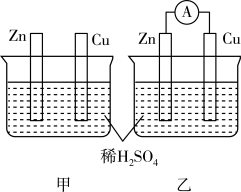
(1)反应过程中能量转化的主要形式:甲为
(2)以下叙述中,正确的是_______(填字母)。
| A.甲中锌片是负极,乙中铜片是正极 | B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 | D.两烧杯中发生的反应相同 |
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为
 离子移向
离子移向 电极的电极反应式为
电极的电极反应式为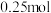 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为
您最近一年使用:0次
名校
6 . 请按要求完成下列方程式的书写。
(1) 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(2)金属钠投入氯化钠溶液_______ 。
(3)酸性条件下 与
与 溶液混合,反应的离子方程式:
溶液混合,反应的离子方程式:_______ 。
(4)氢氧化铁受热分解:_______ 。
(1)
 与
与 反应的化学方程式:
反应的化学方程式:(2)金属钠投入氯化钠溶液
(3)酸性条件下
 与
与 溶液混合,反应的离子方程式:
溶液混合,反应的离子方程式:(4)氢氧化铁受热分解:
您最近一年使用:0次
名校
解题方法
7 . 乳酸在生活中应用广泛,可通过多种途径制得。以淀粉为原料可经过如下转化制得乳酸:________ 。
(2)银氨溶液是实验室常见试剂,以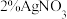 溶液和2%氨水为原料制取银氨溶液的方法是
溶液和2%氨水为原料制取银氨溶液的方法是________ 。
(3)设计检验淀粉与稀硫酸共热后所得水解液中是否含有葡萄糖的实验方案:________ 。
(4)1mol丙酮酸中所含 键的数目为
键的数目为________ 。
(5)乳酸可聚合成易降解的高分子材料,写出该高分子材料分子的结构简式:________ 。
(6)完善以 为原料的物质转化图
为原料的物质转化图______ (燃烧、与酸性 溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
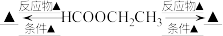
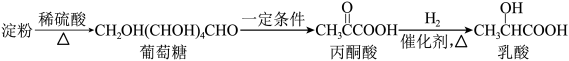
(2)银氨溶液是实验室常见试剂,以
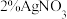 溶液和2%氨水为原料制取银氨溶液的方法是
溶液和2%氨水为原料制取银氨溶液的方法是(3)设计检验淀粉与稀硫酸共热后所得水解液中是否含有葡萄糖的实验方案:
(4)1mol丙酮酸中所含
 键的数目为
键的数目为(5)乳酸可聚合成易降解的高分子材料,写出该高分子材料分子的结构简式:
(6)完善以
 为原料的物质转化图
为原料的物质转化图 溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)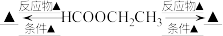
您最近一年使用:0次
今日更新
|
10次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
解题方法
8 . 根据信息书写指定反应的方程式。
(1)请从下列试剂中选择合适的完成指定转化。
试剂: 溶液、稀硝酸、
溶液、稀硝酸、 溶液、
溶液、 溶液、
溶液、 溶液
溶液
① 的离子方程式:
的离子方程式:________ ;
②酸性条件下 (有强氧化性)
(有强氧化性)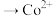 的离子方程式:
的离子方程式:________ 。
(2)工业上可利用氨水吸收 和
和 ,原理如下图所示。
,原理如下图所示。 被氨水吸收后生成含
被氨水吸收后生成含 和
和 溶液的离子方程式:
溶液的离子方程式:________ ;
② 被
被 吸收的离子方程式:
吸收的离子方程式:________ 。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:
 溶液、稀硝酸、
溶液、稀硝酸、 溶液、
溶液、 溶液、
溶液、 溶液
溶液①
 的离子方程式:
的离子方程式:②酸性条件下
 (有强氧化性)
(有强氧化性)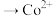 的离子方程式:
的离子方程式:(2)工业上可利用氨水吸收
 和
和 ,原理如下图所示。
,原理如下图所示。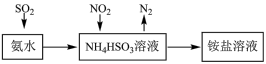
 被氨水吸收后生成含
被氨水吸收后生成含 和
和 溶液的离子方程式:
溶液的离子方程式:②
 被
被 吸收的离子方程式:
吸收的离子方程式:
您最近一年使用:0次
今日更新
|
13次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
9 . 有机物种类繁多、数目庞大、应用广泛。
Ⅰ.请根据官能团的不同对下列有机物进行分类:______ ;酮:______ ,(填序号)。④的官能团名称为______ 。
Ⅱ.现有下列几种有机物:______ (填序号),请用系统命名法命名有机物⑧______ 。
(3)聚丙烯(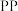 )可制成薄膜、包装材料等,⑦在催化剂条件下合成聚丙烯的化学方程式为
)可制成薄膜、包装材料等,⑦在催化剂条件下合成聚丙烯的化学方程式为______ 。
(4)②的一种同分异构体 为芳香族化合物,其核磁共振氢谱图(
为芳香族化合物,其核磁共振氢谱图( )如图所示:
)如图所示: 的名称为
的名称为______ ,与溴的四氯化碳溶液反应的化学方程式为______ 。
(5)有机物 的一氯代物共
的一氯代物共______ 种。
Ⅰ.请根据官能团的不同对下列有机物进行分类:
① ②
②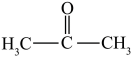 ③
③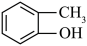 ④
④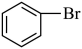
⑤ ⑥
⑥ ⑦
⑦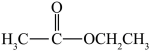
Ⅱ.现有下列几种有机物:
① ;②
;② ;③
;③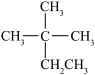 ;④
;④ ;⑤
;⑤ ;
;
⑥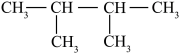 ;⑦丙烯;⑧
;⑦丙烯;⑧ ;
;
⑨ ;⑩
;⑩ 。回答下列问题。
。回答下列问题。
(3)聚丙烯(
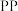 )可制成薄膜、包装材料等,⑦在催化剂条件下合成聚丙烯的化学方程式为
)可制成薄膜、包装材料等,⑦在催化剂条件下合成聚丙烯的化学方程式为(4)②的一种同分异构体
 为芳香族化合物,其核磁共振氢谱图(
为芳香族化合物,其核磁共振氢谱图( )如图所示:
)如图所示:
 的名称为
的名称为(5)有机物
 的一氯代物共
的一氯代物共
您最近一年使用:0次
名校
10 . 根据所学知识,回答下列问题。
(1)已知反应: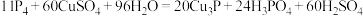 在该反应中,氧化剂是
在该反应中,氧化剂是_______ (填化学式),被氧化的元素是_______ (填元素符号)。
(2)下列状态的物质,既属于电解质又能导电的是_______。(填标号)
(3) 是人体必需的微量元素,其中
是人体必需的微量元素,其中 的中子数是
的中子数是_______ ,其氢化物 的结构式为
的结构式为_______ 。
(4)写出炽热的碳与浓硫酸反应的化学方程式_______ 。
(5)已知反应: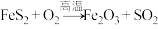 (未配平),若生成标准状况下
(未配平),若生成标准状况下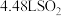 ,则转移的电子数为
,则转移的电子数为_______ 。
(6)往碘化钾溶液中通入少量 ,所发生的离子方程式
,所发生的离子方程式_______ 。
(1)已知反应:
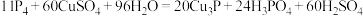 在该反应中,氧化剂是
在该反应中,氧化剂是(2)下列状态的物质,既属于电解质又能导电的是_______。(填标号)
| A.氯化镁晶体 | B.氯化钠溶液 | C.液态氯化氢 | D.熔融氢氧化钾 |
 是人体必需的微量元素,其中
是人体必需的微量元素,其中 的中子数是
的中子数是 的结构式为
的结构式为(4)写出炽热的碳与浓硫酸反应的化学方程式
(5)已知反应:
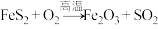 (未配平),若生成标准状况下
(未配平),若生成标准状况下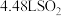 ,则转移的电子数为
,则转移的电子数为(6)往碘化钾溶液中通入少量
 ,所发生的离子方程式
,所发生的离子方程式
您最近一年使用:0次



