1 . H2O、NH3、CH4是常见的非金属氢化物,研究他们的结构有非常重要的意义。
(1)研究H2O分子的结构
①氧的基态原子的电子排布式为_______ 。
②H2O的电子式为_______ ,H2O的VSEPR模型为_______ 。
(2)研究NH3分子的结构
①基态N原子中有_______ 个未成对电子,电子占据的最高能级的符号是_______ 。
②下列有关NH3的说法正确的是_______ 。
a.N的电负性为3.0、H的电负性为1.8,则NH3中N为-3价
b.NH3中N原子的杂化方式是sp2杂化
c.NH3与BF3分子的空间结构相同
(3)研究CH4分子的结构
①基态碳原子中,电子占据最高能级的电子云轮廓图的形状是_______ 。
②CH4分子中碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H_______ 键(填“σ”或“π”),甲烷的空间结构是_______ 。
(4)三种分子比较
① 三种分子中心原子C、N、O的电负性由大到小顺序为_______ 。
② 三种分子中键角H—C—H > H—N—H > H—O—H,原因是_______ 。
(1)研究H2O分子的结构
①氧的基态原子的电子排布式为
②H2O的电子式为
(2)研究NH3分子的结构
①基态N原子中有
②下列有关NH3的说法正确的是
a.N的电负性为3.0、H的电负性为1.8,则NH3中N为-3价
b.NH3中N原子的杂化方式是sp2杂化
c.NH3与BF3分子的空间结构相同
(3)研究CH4分子的结构
①基态碳原子中,电子占据最高能级的电子云轮廓图的形状是
②CH4分子中碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H
(4)三种分子比较
① 三种分子中心原子C、N、O的电负性由大到小顺序为
② 三种分子中键角H—C—H > H—N—H > H—O—H,原因是
您最近一年使用:0次
解题方法
2 . 阅读以下材料,回答相应问题。
当我们把元素周期表的扩增过程放到宇宙发展史中来看时,我们会发现这个过程从大爆炸后的几分钟开始,一直延续到了现在。以氢、氨和锂为代表的第一批元素大概是在宇宙诞生三分钟后合成的。以这些元素为原料,宇宙中的第一批恒星逐渐形成并照亮了宇宙,他们用一生的时间通过核心的核聚变和最终的爆发性死亡生产新元素。在这些高含重元素的爆发残骸中,下一代恒星诞生了。这个过程循环往复到今天。从较轻的氨元素到较重的铁元素,他们的来源都能以此解释。而最重的那些元素,如117号Ts元素,无法自然形成。物理学家可以用粒子加速器强行生产这些元素,但他只能维持不过千分之几秒的时间就迅速衰变。
几十年前,科学家在理论上推测,大约有一半比铁更重的元素产生于快中子俘获过程(或称为r过程)。其余的元素则源自慢中子俘获过程(或称为s过程)。我们对s过程的理解相对充分一些,他由一系列发生在长寿命、低质量恒星中的反应序列组成。
r过程和s过程都会向原子核里添加一个或多个中子。然而,添加中子并不意味着新元素诞生……原子核内的一个中子会转变为一个质子,并释放出一个电子和一个名为中微子的粒子,这就是所谓的贝塔衰变……
s过程和r过程的主要区别在于捕获中子的速度。在s过程中,原子核俘获中子的过程缓慢,在原子核俘获下一个中子之前,被俘获的中子有足够的时间发生贝塔衰变。因为发生s过程的恒星内仅有少量额外的中子,因此原子核只有偶尔才能俘获到新的中子,如此产生新元素的过程需要花费数千年的时间。
相反,r过程则会在一场壮观的闪耀中生成全部重元素,用时不过1秒。在这种场景下,中子的数量充足,在原子核中的其他中子还来不及衰变的时候,他们就一个接一个冲进原子核,使得原子迅速膨大成一个极不稳定的___________,直到达到中子滴线——这是原子核内中子质子比的绝对上限。随后,极重的原子核会发生贝塔衰变,甚至直接分裂成更小的原子核。
——节选自文章《宇宙炼金术》,部分文字有改动
(1)请在以下表格中用实线描出元素周期表(镧系和锕系元素未展开)的上方边框(左、下、右侧边框已画为实线),然后将材料文中提到的所有短周期元素的符号填入周期表的相应格中__________ 。___________ 周期、第___________ 族。
(3)材料最后一段划线空格处不适合 填入以下哪个词________?
(4)2023年6月,科学家在土星的卫星上发现了元素P。根据材料中的理论推测,元素P___________ (填“是”或“不是”)通过快中子俘获过程形成的。P的最高价氧化物是___________ (填“酸性”或“碱性”)氧化物。
当我们把元素周期表的扩增过程放到宇宙发展史中来看时,我们会发现这个过程从大爆炸后的几分钟开始,一直延续到了现在。以氢、氨和锂为代表的第一批元素大概是在宇宙诞生三分钟后合成的。以这些元素为原料,宇宙中的第一批恒星逐渐形成并照亮了宇宙,他们用一生的时间通过核心的核聚变和最终的爆发性死亡生产新元素。在这些高含重元素的爆发残骸中,下一代恒星诞生了。这个过程循环往复到今天。从较轻的氨元素到较重的铁元素,他们的来源都能以此解释。而最重的那些元素,如117号Ts元素,无法自然形成。物理学家可以用粒子加速器强行生产这些元素,但他只能维持不过千分之几秒的时间就迅速衰变。
几十年前,科学家在理论上推测,大约有一半比铁更重的元素产生于快中子俘获过程(或称为r过程)。其余的元素则源自慢中子俘获过程(或称为s过程)。我们对s过程的理解相对充分一些,他由一系列发生在长寿命、低质量恒星中的反应序列组成。
r过程和s过程都会向原子核里添加一个或多个中子。然而,添加中子并不意味着新元素诞生……原子核内的一个中子会转变为一个质子,并释放出一个电子和一个名为中微子的粒子,这就是所谓的贝塔衰变……
s过程和r过程的主要区别在于捕获中子的速度。在s过程中,原子核俘获中子的过程缓慢,在原子核俘获下一个中子之前,被俘获的中子有足够的时间发生贝塔衰变。因为发生s过程的恒星内仅有少量额外的中子,因此原子核只有偶尔才能俘获到新的中子,如此产生新元素的过程需要花费数千年的时间。
相反,r过程则会在一场壮观的闪耀中生成全部重元素,用时不过1秒。在这种场景下,中子的数量充足,在原子核中的其他中子还来不及衰变的时候,他们就一个接一个冲进原子核,使得原子迅速膨大成一个极不稳定的___________,直到达到中子滴线——这是原子核内中子质子比的绝对上限。随后,极重的原子核会发生贝塔衰变,甚至直接分裂成更小的原子核。
——节选自文章《宇宙炼金术》,部分文字有改动
(1)请在以下表格中用实线描出元素周期表(镧系和锕系元素未展开)的上方边框(左、下、右侧边框已画为实线),然后将材料文中提到的所有短周期元素的符号填入周期表的相应格中
(3)材料最后一段划线空格处
| A.同素异形体 | B.粒子 | C.核素 | D.同位素 |
您最近一年使用:0次
解题方法
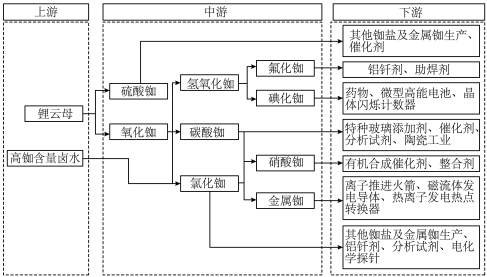
3 . 下图表示铷(Rb)及其化合物的产业链,回答相应问题。___________ (填“小于”或“大于”)钾的离子半径。
(2)写出由氧化铷制备氢氧化铷的化学方程式:___________ 。
(3)写出由氯化铷制备硝酸铷的化学方程式:___________ 。
(4)离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是___________ 。
、
(2)写出由氧化铷制备氢氧化铷的化学方程式:
(3)写出由氯化铷制备硝酸铷的化学方程式:
(4)离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是
您最近一年使用:0次
解题方法
4 . 分别用适量的一种试剂完成以下各组除杂任务(括号内的物质为欲去除杂质),写出除杂反应的化学方程式。
(1)氯化钾(氯化镁)_________ 。
(2)碳酸钠(过氧化钠)_________ 。
(3)镁粉(铝粉)_________ 。
(1)氯化钾(氯化镁)
(2)碳酸钠(过氧化钠)
(3)镁粉(铝粉)
您最近一年使用:0次
名校
5 . 某钙钛矿CH3NH3PbI3是一种新型半导体材料,用于制造太阳能电池。可用CH3OH、NH3、I2、PbI2制备钙钛矿。
(1)晶体I2属于_______ 晶体。
(2)设计实验比较I2在CCl4、水中的溶解性:_______ (操作、现象)。
(3)制备CH3NH3PbI3的过程如下所示:

①Ⅰ中,CH3OH的沸点_______ (>、<、=)CH3I的沸点,原因是_______ 。
②Ⅱ中,由于NH3分子中的_______ 具有孤电子对,容易与CH3I反应生成盐CH3NH3I。
(4)钙钛矿的稳定性受空气中H2O、O2、紫外线等因素的影响。
ⅰ.CH3NH3PbI3(s) PbI2(s)+CH3NH3I(aq)
PbI2(s)+CH3NH3I(aq)
ⅱ.CH3NH3I(aq)⇌CH3NH2(aq)+HI(aq)
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合化学平衡移动原理解释:_______ 。
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的逆合成分析如下:_______ 。
②以乙醇为起始原料,选用必要的无机试剂合成CH3CH2CH2CHO,写出合成路线_______ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
(1)晶体I2属于
(2)设计实验比较I2在CCl4、水中的溶解性:
(3)制备CH3NH3PbI3的过程如下所示:

①Ⅰ中,CH3OH的沸点
②Ⅱ中,由于NH3分子中的
(4)钙钛矿的稳定性受空气中H2O、O2、紫外线等因素的影响。
ⅰ.CH3NH3PbI3(s)
 PbI2(s)+CH3NH3I(aq)
PbI2(s)+CH3NH3I(aq)ⅱ.CH3NH3I(aq)⇌CH3NH2(aq)+HI(aq)
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合化学平衡移动原理解释:
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的逆合成分析如下:
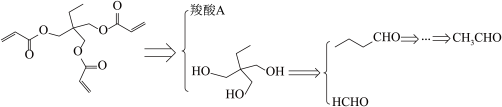
②以乙醇为起始原料,选用必要的无机试剂合成CH3CH2CH2CHO,写出合成路线
已知: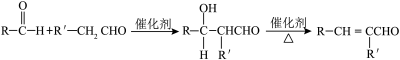 (R、R′表示烃基或氢)。
(R、R′表示烃基或氢)。
您最近一年使用:0次
6 . 镁基储氢材料MgH2具有储氢量高、成本低廉等优点,发展前景广阔。
Ⅰ.MgH2热分解放出H2,反应的能量变化如图所示。_______ 。
(2)提高H2平衡产率的措施有_______ (答1条即可)。
Ⅱ.MgH2水解制备H2。
(3)MgH2与H2O反应制备H2的化学方程式是_______ 。
(4)资料:25℃时,有关物质的溶度积常数如下
①MgH2与H2O反应时,最初生成H2的速率很快,但随后变得缓慢,原因是_______ 。
②在水中加入优先与OH-结合的离子,能够避免①中现象发生,提升H2的制备效率。下列物质中,能达到此目的的是_______ 。
a.NaNO3 b.NiCl2 c.CuCl2
Ⅰ.MgH2热分解放出H2,反应的能量变化如图所示。
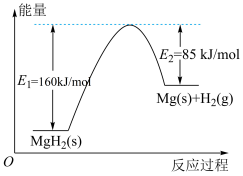
(2)提高H2平衡产率的措施有
Ⅱ.MgH2水解制备H2。
(3)MgH2与H2O反应制备H2的化学方程式是
(4)资料:25℃时,有关物质的溶度积常数如下
| 物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
| Ksp | 5.6×10−12 | 5.5×10−16 | 2.2×10−20 |
②在水中加入优先与OH-结合的离子,能够避免①中现象发生,提升H2的制备效率。下列物质中,能达到此目的的是
a.NaNO3 b.NiCl2 c.CuCl2
您最近一年使用:0次
解题方法
7 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.100 mol/L NaOH溶液滴定10 mL 0.100 mol/L CH3COOH溶液的滴定曲线如图所示。
①c(Na+) =c(CH3COO−)的点是_______ (填“a”、“b”或“c”,下同)。
②水的电离程度最大的点是_______ 。
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
①CH3COOH的电离平衡常数表达式Ka=_______ 。
②比较等物质的量浓度溶液的pH:pH(NaClO)_______ pH(CH3COONa) (填“>”、“<”或“=”)。
③预测下列化学反应能够发生的是_______ 。
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2
(1)常温下,用0.100 mol/L NaOH溶液滴定10 mL 0.100 mol/L CH3COOH溶液的滴定曲线如图所示。
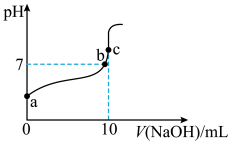
①c(Na+) =c(CH3COO−)的点是
②水的电离程度最大的点是
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常(Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
②比较等物质的量浓度溶液的pH:pH(NaClO)
③预测下列化学反应能够发生的是
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2
您最近一年使用:0次
名校
解题方法
8 . 高熵合金是指由多种元素(如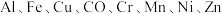 等)形成的合金,因其独特的元素组成、微观结构和性能,被认为是极具应用潜力的新型结构材料。
等)形成的合金,因其独特的元素组成、微观结构和性能,被认为是极具应用潜力的新型结构材料。
(1) 是目前采用最多的商熵合金元素组合。
是目前采用最多的商熵合金元素组合。
① 元素与同周期左侧相邻的元素比较,第一电离能由大到小的顺序是
元素与同周期左侧相邻的元素比较,第一电离能由大到小的顺序是___________ (用元素符号表示),请从原子结构角度解释原因:___________
②基态 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为___________ 。
③ 元素位于元素周期表的
元素位于元素周期表的___________ 区。
(2)研究人员发现,在离子液体中可制备均一粒径分布的高熵合金纳米颗粒。离子液体是在室温和接近室温时呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。一种离子液体的结构如图所示。 的空间结构为
的空间结构为___________ 。
②研究发现通过改变阳离子侧链可调控离子化合物的熔点。 两种离子液体的结构如图所示。熔点
两种离子液体的结构如图所示。熔点 的原因是
的原因是___________ 。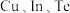 元素形成的高熵合金,其晶胞结构如下图所示,晶胞棱边夹角均为
元素形成的高熵合金,其晶胞结构如下图所示,晶胞棱边夹角均为 。
。 原子与邻近的
原子与邻近的 原子构成的空间结构为
原子构成的空间结构为___________ 。
②已知阿伏伽德罗常数的值为 ,该晶体的密度为
,该晶体的密度为___________ 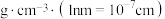 (列出计算式)。
(列出计算式)。
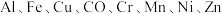 等)形成的合金,因其独特的元素组成、微观结构和性能,被认为是极具应用潜力的新型结构材料。
等)形成的合金,因其独特的元素组成、微观结构和性能,被认为是极具应用潜力的新型结构材料。(1)
 是目前采用最多的商熵合金元素组合。
是目前采用最多的商熵合金元素组合。①
 元素与同周期左侧相邻的元素比较,第一电离能由大到小的顺序是
元素与同周期左侧相邻的元素比较,第一电离能由大到小的顺序是②基态
 原子的价层电子的轨道表示式为
原子的价层电子的轨道表示式为③
 元素位于元素周期表的
元素位于元素周期表的(2)研究人员发现,在离子液体中可制备均一粒径分布的高熵合金纳米颗粒。离子液体是在室温和接近室温时呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。一种离子液体的结构如图所示。
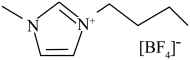
 的空间结构为
的空间结构为②研究发现通过改变阳离子侧链可调控离子化合物的熔点。
 两种离子液体的结构如图所示。熔点
两种离子液体的结构如图所示。熔点 的原因是
的原因是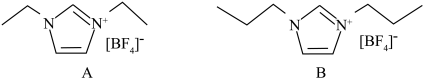
 元素形成的高熵合金,其晶胞结构如下图所示,晶胞棱边夹角均为
元素形成的高熵合金,其晶胞结构如下图所示,晶胞棱边夹角均为 。
。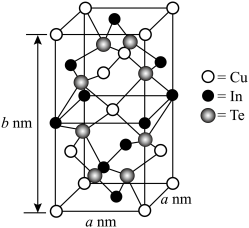
 原子与邻近的
原子与邻近的 原子构成的空间结构为
原子构成的空间结构为②已知阿伏伽德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为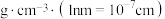 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
9 . 小组同学用糯米酿制米酒,实验步骤如下:
步骤1.将糯米洗净,蒸熟,放凉。
步骤2.将甜酒曲碾成粉末,与糯米充分搅拌,装入干净的容器。
步骤3.将容器盖严,置于恒温环境中发酵。
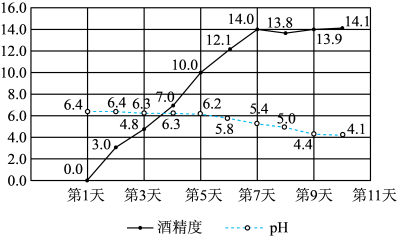
步骤4.每隔一天测定米酒的酒精度和pH,结果如下图。
(1)步骤2中,为增大反应速率采取的措施有___________ (答出两点)。
(2)步骤3的主要转化如下。
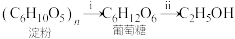
下列说法正确的是___________ (填字母)。
a.淀粉属于天然高分子
b.人体中也能发生ⅰ的转化
c.ⅱ的原子利用率为
(3)步骤3中会产生乙酸、乳酸(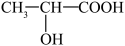 )等物质,导致米酒pH逐渐减小。鉴别乙酸和乳酸的最佳试剂是
)等物质,导致米酒pH逐渐减小。鉴别乙酸和乳酸的最佳试剂是___________ (填字母)。
a.Na b. 溶液 c.酸性
溶液 c.酸性 溶液
溶液
(4)步骤3中还会产生酯类物质(如乙酸乙酯)使米酒具有香味。工业上以乙烯为原料制备乙酸乙酯的两种方法如下。___________ 。
②写出反应ⅰ的化学方程式:___________ 。
②ⅱ的反应类型为加成反应,试剂Z为___________ 。
步骤1.将糯米洗净,蒸熟,放凉。
步骤2.将甜酒曲碾成粉末,与糯米充分搅拌,装入干净的容器。
步骤3.将容器盖严,置于恒温环境中发酵。
步骤4.每隔一天测定米酒的酒精度和pH,结果如下图。
(1)步骤2中,为增大反应速率采取的措施有
(2)步骤3的主要转化如下。
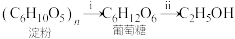
下列说法正确的是
a.淀粉属于天然高分子
b.人体中也能发生ⅰ的转化
c.ⅱ的原子利用率为

(3)步骤3中会产生乙酸、乳酸(
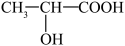 )等物质,导致米酒pH逐渐减小。鉴别乙酸和乳酸的最佳试剂是
)等物质,导致米酒pH逐渐减小。鉴别乙酸和乳酸的最佳试剂是a.Na b.
 溶液 c.酸性
溶液 c.酸性 溶液
溶液(4)步骤3中还会产生酯类物质(如乙酸乙酯)使米酒具有香味。工业上以乙烯为原料制备乙酸乙酯的两种方法如下。
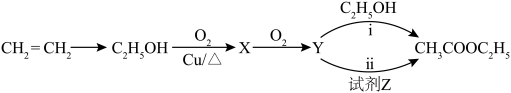
②写出反应ⅰ的化学方程式:
②ⅱ的反应类型为加成反应,试剂Z为
您最近一年使用:0次
10 . H2SO4是一种重要的工业原料,可采用多种方法制备。
(1)方法一:古代通过焙烧绿矾(FeSO4•7H2O)的方法制备硫酸。
补全绿矾受热分解的化学方程式:______ 。
 FeSO4•7H2O
FeSO4•7H2O
 ______+SO2↑+SO3↑+
______+SO2↑+SO3↑+ H2O↑
H2O↑
(2)方法二:以含硫矿石为原料,接触法制硫酸。其中关键反应为SO2的催化氧化。在V2O5催化作用下反应分两步进行,其反应过程中的能量变化示意图如图。________ (填序号)。
a.反应i为吸热反应,反应ii为放热反应
b.反应i为决速步,其活化能为E2
c.V2O5改变了反应速率,未改变反应焓变
②该反应中提高SO2平衡转化率的方法有_______ 、_______ 。
(3)研究表明可以用烟气中的SO2为原料制备硫酸,先用Na2SO3溶液充分吸收SO2获得NaHSO3溶液,然后电解该溶液制得硫酸,其原理如图所示。______ 极。
②电解过程中生成SO 的电极反应式是
的电极反应式是______ 。
③从资源利用角度说明该工艺的优点_____ 。
(1)方法一:古代通过焙烧绿矾(FeSO4•7H2O)的方法制备硫酸。
补全绿矾受热分解的化学方程式:
 FeSO4•7H2O
FeSO4•7H2O
 ______+SO2↑+SO3↑+
______+SO2↑+SO3↑+ H2O↑
H2O↑(2)方法二:以含硫矿石为原料,接触法制硫酸。其中关键反应为SO2的催化氧化。在V2O5催化作用下反应分两步进行,其反应过程中的能量变化示意图如图。
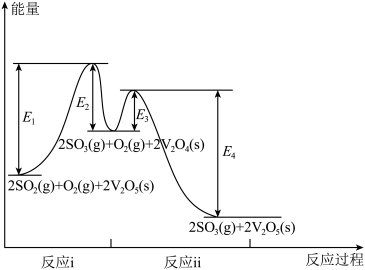
a.反应i为吸热反应,反应ii为放热反应
b.反应i为决速步,其活化能为E2
c.V2O5改变了反应速率,未改变反应焓变
②该反应中提高SO2平衡转化率的方法有
(3)研究表明可以用烟气中的SO2为原料制备硫酸,先用Na2SO3溶液充分吸收SO2获得NaHSO3溶液,然后电解该溶液制得硫酸,其原理如图所示。
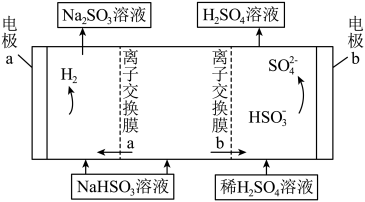
②电解过程中生成SO
 的电极反应式是
的电极反应式是③从资源利用角度说明该工艺的优点
您最近一年使用:0次



