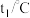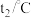名校
1 . 钴及其化合物应用广泛。回答下列问题:
(1)Co元素在元素周期表中位于第_______ 周期第________ 族,基态Co原子的价层电子排布式为___________ 。
(2)可由5-氰基四唑(结构简式如图)和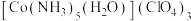 反应制备起爆药CP。
反应制备起爆药CP。___________ ,C原子的杂化方式为___________ 。
②在配合物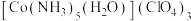 中,中心原子的配位数为
中,中心原子的配位数为___________ ,钴元素的化合价为___________ ,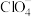 的空间结构为
的空间结构为___________ 。
(1)Co元素在元素周期表中位于第
(2)可由5-氰基四唑(结构简式如图)和
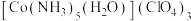 反应制备起爆药CP。
反应制备起爆药CP。
②在配合物
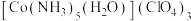 中,中心原子的配位数为
中,中心原子的配位数为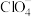 的空间结构为
的空间结构为
您最近一年使用:0次
名校
2 . 回答下列问题
I、2021年4月13日,日本政府召开相关阁僚会议,正式决定向海洋排放福岛第一核电站含有对海洋环境有害的核废水,并将核废水主要辐射物质“氚(T)”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。___________ 。
A.卡通形象中标“+”号的小球表示质子
B.氚的核素符号为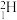
C.氚和及其同位素性质不完全相同
(2)有关 和
和 的说法正确的是___________。
的说法正确的是___________。
(3)已知天然氢元素中:氕的丰度为 ,氘的丰度为
,氘的丰度为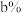 ,氚的丰度为
,氚的丰度为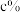 ;氕、氘、氚原子的实际质量分别用
;氕、氘、氚原子的实际质量分别用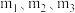 表示,
表示,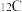 原子的质量用
原子的质量用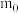 表示。则氢元素的相对原子质量计算表达式为
表示。则氢元素的相对原子质量计算表达式为___________ 。
(4)在离子 中,电子数、质子数和中子数之比为
中,电子数、质子数和中子数之比为___________ 。
II、硼氢化钠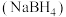 是有机合成中常用的还原剂
是有机合成中常用的还原剂
(5)硼氢化钠中存在的化学键为___________ (填标号)。
a.离子键 b.氢键 c.共价键 d.配位键
(6)已知 的第一电离能大于B的第一电离能,原因为
的第一电离能大于B的第一电离能,原因为___________ 。
(7)___________  的还原能力与标准状况下
的还原能力与标准状况下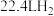 的还原能力相当(已知电负性:
的还原能力相当(已知电负性: ;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
I、2021年4月13日,日本政府召开相关阁僚会议,正式决定向海洋排放福岛第一核电站含有对海洋环境有害的核废水,并将核废水主要辐射物质“氚(T)”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。

A.卡通形象中标“+”号的小球表示质子
B.氚的核素符号为
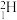
C.氚和及其同位素性质不完全相同
(2)有关
 和
和 的说法正确的是___________。
的说法正确的是___________。| A.互为同位素 | B.互为同素异形体 |
| C.电子数不同 | D.同温同压下密度之比为 |
 ,氘的丰度为
,氘的丰度为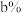 ,氚的丰度为
,氚的丰度为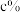 ;氕、氘、氚原子的实际质量分别用
;氕、氘、氚原子的实际质量分别用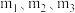 表示,
表示,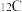 原子的质量用
原子的质量用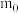 表示。则氢元素的相对原子质量计算表达式为
表示。则氢元素的相对原子质量计算表达式为(4)在离子
 中,电子数、质子数和中子数之比为
中,电子数、质子数和中子数之比为II、硼氢化钠
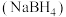 是有机合成中常用的还原剂
是有机合成中常用的还原剂(5)硼氢化钠中存在的化学键为
a.离子键 b.氢键 c.共价键 d.配位键
(6)已知
 的第一电离能大于B的第一电离能,原因为
的第一电离能大于B的第一电离能,原因为(7)
 的还原能力与标准状况下
的还原能力与标准状况下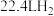 的还原能力相当(已知电负性:
的还原能力相当(已知电负性: ;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
;还原能力可用还原剂发生反应时失去电子的物质的量来衡量)。
您最近一年使用:0次
名校
3 . 在 密闭容器中,800℃时,反应
密闭容器中,800℃时,反应 体系中,
体系中,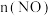 随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
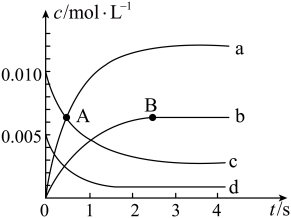
(1) 用
用 表示的化学反应速率
表示的化学反应速率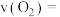
_______ 。从表中可以看出,该反应化学反应速率逐渐减慢,原因是_______ 。
(2)图中 点处反应
点处反应_______ (填“已达到”或“未达到”)平衡状态,A点处v(正)_______ (填“>”或“<”)v(逆)。
(3)若要加快该反应速率,可以采取的措施是_______ (任写两点)。
(4)下列能够说明反应已达到平衡状态的是_______(填字母)。
(5)已知该反应为放热反应,若生成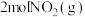 放出热量为
放出热量为 ,则通入
,则通入 与足量
与足量 充分反应生成
充分反应生成 放出的热量
放出的热量_______ (填“>”“<”或“=”)Q。
 密闭容器中,800℃时,反应
密闭容器中,800℃时,反应 体系中,
体系中,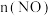 随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。
随时间的变化如下表所示,各物质的浓度一时间曲线如图所示。时间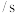 | 0 | 1 | 2 | 3 | 4 | 5 |
 | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)
 用
用 表示的化学反应速率
表示的化学反应速率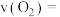
(2)图中
 点处反应
点处反应(3)若要加快该反应速率,可以采取的措施是
(4)下列能够说明反应已达到平衡状态的是_______(填字母)。
| A.混合气体的颜色不再变化 | B.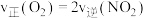 |
| C.混合气体平均摩尔质量保持不变 | D. 发生反应同时生成 发生反应同时生成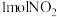 |
(5)已知该反应为放热反应,若生成
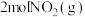 放出热量为
放出热量为 ,则通入
,则通入 与足量
与足量 充分反应生成
充分反应生成 放出的热量
放出的热量
您最近一年使用:0次
名校
4 . 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为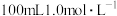 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。
(1)反应过程中能量转化的主要形式:甲为_______ ;乙为_______ 。
(2)以下叙述中,正确的是_______(填字母)。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为_______ (填“正极”或“负极”,下同), 离子移向
离子移向_______ , 电极的电极反应式为
电极的电极反应式为_______ ,当外电路中转移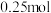 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为_______ (保留三位小数)。
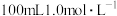 的稀硫酸(假设反应过程中溶液体积不变),乙中
的稀硫酸(假设反应过程中溶液体积不变),乙中 为电流表。
为电流表。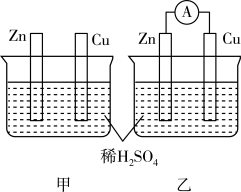
(1)反应过程中能量转化的主要形式:甲为
(2)以下叙述中,正确的是_______(填字母)。
| A.甲中锌片是负极,乙中铜片是正极 | B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 | D.两烧杯中发生的反应相同 |
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极为
 离子移向
离子移向 电极的电极反应式为
电极的电极反应式为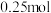 电子时,消耗负极材料的质量为
电子时,消耗负极材料的质量为
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.300℃时,向2L的恒容密闭容器中,充入等物质的量的 和
和 使之发生反应
使之发生反应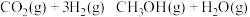 ,测得各物质的量浓度变化如图所示:
,测得各物质的量浓度变化如图所示: 的浓度随时间的变化为曲线
的浓度随时间的变化为曲线_____ (填“a”“b”或“c”);2min内的平均反应速率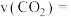
_____ 。
(2)已知:反应至2min时,改变了某一反应条件。2min时改变的条件可能为:_____。
(3)能说明上述反应达到平衡状态的是_____ (填字母)。
a.
b.混合气体的密度不随时间的变化而变化
c.
d.混合气体的平均摩尔质量不随时间的变化而变化
(4)5min时,容器内气体总压强与反应前容器内气体总压强之比为_____ 。
Ⅱ.向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。_____ (选填“吸热”或“放热”)反应,
(6)判断图中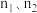 相对大小:
相对大小: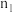 *
*_____ * 。(选填“<”或“>”)
。(选填“<”或“>”)
 和
和 使之发生反应
使之发生反应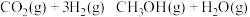 ,测得各物质的量浓度变化如图所示:
,测得各物质的量浓度变化如图所示:
 的浓度随时间的变化为曲线
的浓度随时间的变化为曲线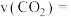
(2)已知:反应至2min时,改变了某一反应条件。2min时改变的条件可能为:_____。
| A.升高温度 | B.加催化剂 |
| C.减小容器体积,增大压强 | D.增大反应物浓度 |
(3)能说明上述反应达到平衡状态的是
a.

b.混合气体的密度不随时间的变化而变化
c.

d.混合气体的平均摩尔质量不随时间的变化而变化
(4)5min时,容器内气体总压强与反应前容器内气体总压强之比为
Ⅱ.向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的
 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如图所示。
(6)判断图中
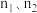 相对大小:
相对大小: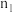 *
* 。(选填“<”或“>”)
。(选填“<”或“>”)
您最近一年使用:0次
名校
6 . 氨气的催化氧化反应是工业制备硝酸的基础。由氨气为原料合成硝酸工业中有含NO、 等氮氧化物的尾气排出,有多种方法解决污染环境。
等氮氧化物的尾气排出,有多种方法解决污染环境。
(1)氨气催化氧化的化学反应方程式:_____
(2) 溶液吸收法处理尾气:使用具有碱性的碳酸钠溶液吸收尾气中
溶液吸收法处理尾气:使用具有碱性的碳酸钠溶液吸收尾气中 可产生硝酸钠,该反应的化学方程式为
可产生硝酸钠,该反应的化学方程式为_____ ;
(3)氨气催化吸收法处理尾气法:已知8mol氨气恰好能将含NO和 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比
的物质的量之比_____ ;
(4)NaOH溶液吸收NO和 法:
法:
已知:
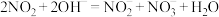 。吸收后的溶液经浓缩、结晶、过滤,得到
。吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是_____ (填化学式);吸收后释放的尾气中常量较高的氮氧化物是_____ (填化学式)。
(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为_____ ;
②NaClO溶液的初始pH越小NO转化率越高。其原因是_____ 。
 等氮氧化物的尾气排出,有多种方法解决污染环境。
等氮氧化物的尾气排出,有多种方法解决污染环境。(1)氨气催化氧化的化学反应方程式:
(2)
 溶液吸收法处理尾气:使用具有碱性的碳酸钠溶液吸收尾气中
溶液吸收法处理尾气:使用具有碱性的碳酸钠溶液吸收尾气中 可产生硝酸钠,该反应的化学方程式为
可产生硝酸钠,该反应的化学方程式为(3)氨气催化吸收法处理尾气法:已知8mol氨气恰好能将含NO和
 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比
的物质的量之比(4)NaOH溶液吸收NO和
 法:
法:已知:

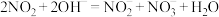 。吸收后的溶液经浓缩、结晶、过滤,得到
。吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小NO转化率越高。其原因是
您最近一年使用:0次
名校
7 . 根据要求,回答下列问题:
(1)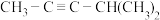 的名称为
的名称为___________ , 的名称为
的名称为___________ 。
(2)某烷烃分子的碳骨架结构为 ,此烷烃的一溴代物有
,此烷烃的一溴代物有___________ 种。若此烷烃为炔烃加氢制得,则此炔烃的结构简式为___________ 。
(3)用核磁共振仪对分子式为 的有机物进行分析,核磁共振氢谱有三组峰,且峰面积比为
的有机物进行分析,核磁共振氢谱有三组峰,且峰面积比为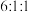 ,则该化合物的键线式为
,则该化合物的键线式为___________ 。
(4)X为有机物 的同分异构体,同时满足如下三个条件的所有的X的结构简式为
的同分异构体,同时满足如下三个条件的所有的X的结构简式为___________ 。
①含有苯环;
②有三种不同化学环境的氢,个数比为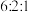 ;
;
③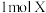 与足量金属Na反应可生成
与足量金属Na反应可生成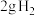
(1)
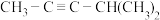 的名称为
的名称为 的名称为
的名称为(2)某烷烃分子的碳骨架结构为
 ,此烷烃的一溴代物有
,此烷烃的一溴代物有(3)用核磁共振仪对分子式为
 的有机物进行分析,核磁共振氢谱有三组峰,且峰面积比为
的有机物进行分析,核磁共振氢谱有三组峰,且峰面积比为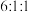 ,则该化合物的键线式为
,则该化合物的键线式为(4)X为有机物
 的同分异构体,同时满足如下三个条件的所有的X的结构简式为
的同分异构体,同时满足如下三个条件的所有的X的结构简式为①含有苯环;
②有三种不同化学环境的氢,个数比为
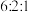 ;
;③
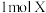 与足量金属Na反应可生成
与足量金属Na反应可生成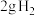
您最近一年使用:0次
名校
8 . 一定条件下,在体积为 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 的物质的量与时间变化图象如图:
的物质的量与时间变化图象如图: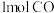 和
和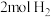 ,则达平行时,CO和
,则达平行时,CO和 的转化率之比为
的转化率之比为________ ;
(2)若起始时加入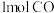 和
和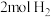 ,达平衡后,使容器内物质全部发生完全燃烧,将产物通过足量的
,达平衡后,使容器内物质全部发生完全燃烧,将产物通过足量的 固体,则固体增重
固体,则固体增重________ ;
(3) 时,从反应开始到达到化学平衡,以
时,从反应开始到达到化学平衡,以 的浓度变化表示的化学反应速率是
的浓度变化表示的化学反应速率是________ ;(用 ,
, 表示)
表示)
(4) 时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________ ;
a. 的物质的量增加
的物质的量增加
b.正反应速率加快,逆反应速率减慢
c.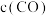 和
和 均减小
均减小
d.重新平衡时 减小
减小
(5)向含有 和
和 的稀溶液中加入足量的铁屑,最终产生气体的物质的量为
的稀溶液中加入足量的铁屑,最终产生气体的物质的量为________ ,溶解铁屑的质量为________ g。
 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 的物质的量与时间变化图象如图:
的物质的量与时间变化图象如图: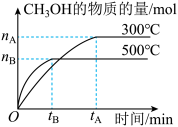
 和
和 ,则达平行时,CO和
,则达平行时,CO和 的转化率之比为
的转化率之比为(2)若起始时加入
 和
和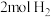 ,达平衡后,使容器内物质全部发生完全燃烧,将产物通过足量的
,达平衡后,使容器内物质全部发生完全燃烧,将产物通过足量的 固体,则固体增重
固体,则固体增重(3)
 时,从反应开始到达到化学平衡,以
时,从反应开始到达到化学平衡,以 的浓度变化表示的化学反应速率是
的浓度变化表示的化学反应速率是 ,
, 表示)
表示)(4)
 时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是a.
 的物质的量增加
的物质的量增加b.正反应速率加快,逆反应速率减慢
c.
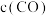 和
和 均减小
均减小d.重新平衡时
 减小
减小(5)向含有
 和
和 的稀溶液中加入足量的铁屑,最终产生气体的物质的量为
的稀溶液中加入足量的铁屑,最终产生气体的物质的量为
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知 和
和 的燃烧热
的燃烧热 分别为
分别为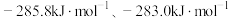 和-
和- 。请回答:
。请回答:
①用太阳能分解 水消耗的能量是
水消耗的能量是_______________ 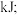
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______________ 。
(2)热力学标准态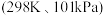 下,由稳定单质发生反应生成
下,由稳定单质发生反应生成 化合物的反应热叫该化合物的生成热
化合物的反应热叫该化合物的生成热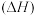 。如图为第VIA族元素(包括
。如图为第VIA族元素(包括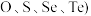 氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
氢化物a、b、c、d的生成热数据示意图。试完成下列问题。 对应的氢化物是
对应的氢化物是_______________ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系是:
的关系是:_______________ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为_______________ 。
(沸点:硒化氢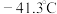 ;硒:
;硒: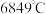 )
)
(3)某小组用 溶液和
溶液和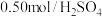 溶液进行中和热的测定。
溶液进行中和热的测定。
①取 溶液和
溶液和 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。
近似认为 溶液和
溶液和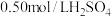 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容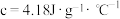 ,则
,则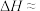
_________ (结果保留小数点后一位)。
②已知强酸强碱的稀溶液反应生成 液态
液态 时反应放出的热量为
时反应放出的热量为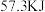 ,
,
上述实验产生偏差的原因可能是____________ (填字母)。
A.实验装置保温、隔热效果差
B.量取 溶液的体积时仰视读数
溶液的体积时仰视读数
C.把 溶液快速的一次性倒入盛有硫酸的量热计中
溶液快速的一次性倒入盛有硫酸的量热计中
D.用温度计测定 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
(1)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知
 和
和 的燃烧热
的燃烧热 分别为
分别为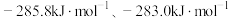 和-
和- 。请回答:
。请回答:①用太阳能分解
 水消耗的能量是
水消耗的能量是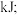
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(2)热力学标准态
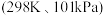 下,由稳定单质发生反应生成
下,由稳定单质发生反应生成 化合物的反应热叫该化合物的生成热
化合物的反应热叫该化合物的生成热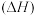 。如图为第VIA族元素(包括
。如图为第VIA族元素(包括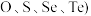 氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
氢化物a、b、c、d的生成热数据示意图。试完成下列问题。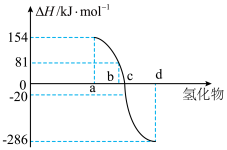
 对应的氢化物是
对应的氢化物是 的关系是:
的关系是:②硒化氢在上述条件下发生分解反应的热化学方程式为
(沸点:硒化氢
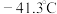 ;硒:
;硒: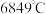 )
)(3)某小组用
 溶液和
溶液和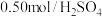 溶液进行中和热的测定。
溶液进行中和热的测定。①取
 溶液和
溶液和 溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。实验次数 | 起始温度 | 终止温度 | ||
|
| 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.9 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 26.3 | 26.1 | 26.2 | 30.2 |
 溶液和
溶液和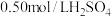 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容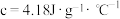 ,则
,则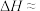
②已知强酸强碱的稀溶液反应生成
 液态
液态 时反应放出的热量为
时反应放出的热量为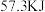 ,
,上述实验产生偏差的原因可能是
A.实验装置保温、隔热效果差
B.量取
 溶液的体积时仰视读数
溶液的体积时仰视读数C.把
 溶液快速的一次性倒入盛有硫酸的量热计中
溶液快速的一次性倒入盛有硫酸的量热计中D.用温度计测定
 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
您最近一年使用:0次
10 . 合成氨技术的创立开辟了人工固氮的重要途径。
(1)已知:N2(g)+3H2(g) 2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。_______ ;用化学方程式表示出对总反应速率影响较大的步骤_______ 。
(2)某化学研究性学习小组模拟工业合成氨的反应。控制压强为20 MPa、温度在700K,将N2(g)和H2(g)按照体积比1:3充入密闭容器合成NH3(g)。当反应达到平衡状态时,体系中NH3的体积分数为60%,则化学平衡常数Kp=_______ (结果保留两位小数)
已知:气体分压=气体总压×气体体积分数
(3)在合成氨工业中,要使氨的平衡产率增大,同时又能提高反应速率,可采取的措施有_______
a.使用催化剂 b.恒温恒容,增大原料气N2和H2充入量
c.升高温度 d.恒温恒容,充入惰性气体Ar使压强增大
(4)合成氨时压强越大,原料的转化率越高,我国合成氨厂采用的压强为10Mpa-30Mpa,没有采用过大压强的主要原因是_______ ,合成氨前,原料气必须经过净化处理,以防止_______ 和安全事故发生。
(5)在容积为VL的恒温密闭容器中,充入N2和H2的总物质的量为1mol,容器内各组分的物质的量分数与反应时间t的关系如图所示。_______ mol·L-1·min-1
②a表示_______ 的物质的量分数的变化情况。(填N2、 H2 或NH3 )
(1)已知:N2(g)+3H2(g)
 2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
2NH3(g) △H=akJ·mol-1的反应历程和能量变化如图所示,标注“*”表示在催化剂表面吸附的物质。
(2)某化学研究性学习小组模拟工业合成氨的反应。控制压强为20 MPa、温度在700K,将N2(g)和H2(g)按照体积比1:3充入密闭容器合成NH3(g)。当反应达到平衡状态时,体系中NH3的体积分数为60%,则化学平衡常数Kp=
已知:气体分压=气体总压×气体体积分数
(3)在合成氨工业中,要使氨的平衡产率增大,同时又能提高反应速率,可采取的措施有
a.使用催化剂 b.恒温恒容,增大原料气N2和H2充入量
c.升高温度 d.恒温恒容,充入惰性气体Ar使压强增大
(4)合成氨时压强越大,原料的转化率越高,我国合成氨厂采用的压强为10Mpa-30Mpa,没有采用过大压强的主要原因是
(5)在容积为VL的恒温密闭容器中,充入N2和H2的总物质的量为1mol,容器内各组分的物质的量分数与反应时间t的关系如图所示。

②a表示
您最近一年使用:0次