23-24高二下·全国·课前预习
1 . VSEPR模型与中心原子的杂化轨道类型
| VSEPR模型 | 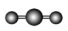 | 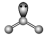 | 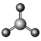 | 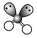 |  | 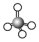 |
| VSEPR模型名称 | 直线形 | 平面三角形 | 平面三角形 | 四面体 | 四面体 | 正四面体 |
| 中心原子的杂化轨道类型 | ||||||
| 典例 | SO2 | SO3 | H2O | NH3 | CH4 |
您最近一年使用:0次
名校
解题方法
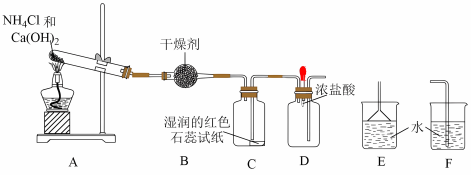
2 . 某实验小组利用以下装置制取氨气并探究氨气的性质:_____ 。
(2)装置B中的干燥剂是_____ (填名称)。
(3)装置C中的现象是_____ 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_____ ,发生反应的化学方程式为_____ 。
(5)为防止过量氨气外逸,需在上述装置末端增加尾气吸收装置,应选用的装置是_____ (填“E”或“F”)。
(2)装置B中的干燥剂是
(3)装置C中的现象是
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)为防止过量氨气外逸,需在上述装置末端增加尾气吸收装置,应选用的装置是
您最近一年使用:0次
2024-02-03更新
|
939次组卷
|
5卷引用:5.2.2氨和铵盐课后作业提高篇
3 . 乙烯是世界上产量最大的化学产品之一,世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。如图是有关乙烯的一些变化,根据乙烯的转化图,完成下列问题:
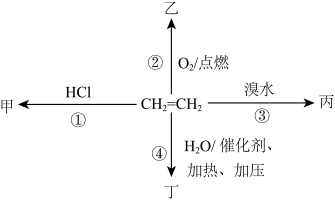
(1)乙烯的电子式___________ 。
(2)①③的反应类型为___________ 、___________ 。
(3)丙的结构简式为___________ ,丁中的官能团为___________ 。
(4)反应②的化学方程式为___________ 。
(5)写出用丁及其它物质反应生成乙醛的化学方程式___________ 。

(1)乙烯的电子式
(2)①③的反应类型为
(3)丙的结构简式为
(4)反应②的化学方程式为
(5)写出用丁及其它物质反应生成乙醛的化学方程式
您最近一年使用:0次
解题方法
4 . 图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
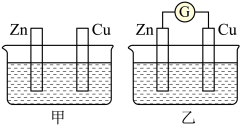
(1)以下叙述中,正确的是_________ 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的 均增大
均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中 向锌片方向移动
向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为_________ (填写选项字母);乙为_________ (同前)。
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有 电子发生转移,则生成的氢气在标况下的体积为
电子发生转移,则生成的氢气在标况下的体积为_________ ;溶液质量增加_________ g。
(4)下列反应可以作为原电池工作时发生的反应的是:_________。
(5)乙中负极电极反应方程式为:___________________________ 。

(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的
 均增大
均增大D.乙中电子从铜片经导线流向锌片
E.乙溶液中
 向锌片方向移动
向锌片方向移动(2)变化过程中能量转化的形式主要是:甲为
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有
 电子发生转移,则生成的氢气在标况下的体积为
电子发生转移,则生成的氢气在标况下的体积为(4)下列反应可以作为原电池工作时发生的反应的是:_________。
A.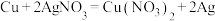 |
B.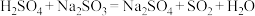 |
C. |
D.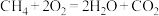 |
(5)乙中负极电极反应方程式为:
您最近一年使用:0次
5 . 回答下列问题。
(1)基态原子的核外电子填充在6个轨道中的元素有___________ 种,基态 原子中,核外电子占据最高能层的符号是
原子中,核外电子占据最高能层的符号是___________ 。
(2)下列 原子电子排布图表示的状态中,能量最低和最高的分别为
原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
a.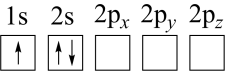 b.
b.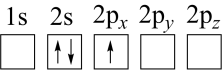
c.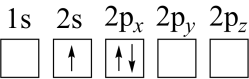 d.
d.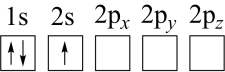
(3)基态 价层电子的电子排布图(轨道表达式)为
价层电子的电子排布图(轨道表达式)为___________ ,基态 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为___________ 形。
(4) 基态原子的简化核外电子排布式为
基态原子的简化核外电子排布式为___________ 。元素 与
与 中,基态原子核外未成对电子数较多的是
中,基态原子核外未成对电子数较多的是___________ 。
(1)基态原子的核外电子填充在6个轨道中的元素有
 原子中,核外电子占据最高能层的符号是
原子中,核外电子占据最高能层的符号是(2)下列
 原子电子排布图表示的状态中,能量最低和最高的分别为
原子电子排布图表示的状态中,能量最低和最高的分别为a.
 b.
b.
c.
 d.
d.
(3)基态
 价层电子的电子排布图(轨道表达式)为
价层电子的电子排布图(轨道表达式)为 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为(4)
 基态原子的简化核外电子排布式为
基态原子的简化核外电子排布式为 与
与 中,基态原子核外未成对电子数较多的是
中,基态原子核外未成对电子数较多的是
您最近一年使用:0次
6 . 填空。
(1)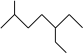 名称为
名称为___________ 。
(2)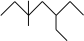 名称为
名称为___________ 。
(3) 名称为
名称为___________ 。
(4)2,3-二甲基-4-乙基庚烷的结构简式为___________ 。
(1)
 名称为
名称为(2)
 名称为
名称为(3)
 名称为
名称为(4)2,3-二甲基-4-乙基庚烷的结构简式为
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)从海水中得到的粗盐中常含 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入_______ 、_______ 、_______ 、稀盐酸来进行提纯。加入适量盐酸的目的是_______ 。
(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。
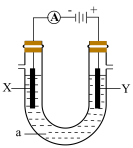
①写出该电解反应的化学方程式_______ 。
②简述检测Y极附近产生的气体的实验方案:_______
(3)下列方法可用于海水淡化的是_______ (填字母)。
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂, 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为_______ 。
②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:_______ 。
(5)目前很多自来水厂使用 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: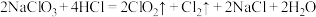 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况_______ 。
(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为_______ 。
②软锰矿(主要成分 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为_______ 。
(1)从海水中得到的粗盐中常含
 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。

①写出该电解反应的化学方程式
②简述检测Y极附近产生的气体的实验方案:
(3)下列方法可用于海水淡化的是
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂,
 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:(5)目前很多自来水厂使用
 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: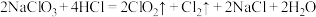 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和
 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为②软锰矿(主要成分
 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
8 . 完成下列各题。
(1)Zn原子核外电子排布式为______ 。
(2)Fe成为阳离子时首先失去______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______ 。
(3)Fe2+基态核外电子排布式为______ 。
(4)基态K原子中,核外电子占据最高能层的符号是______ 。
(5)基态Ge原子的核外电子排布式为[Ar]_______ 。
(1)Zn原子核外电子排布式为
(2)Fe成为阳离子时首先失去
(3)Fe2+基态核外电子排布式为
(4)基态K原子中,核外电子占据最高能层的符号是
(5)基态Ge原子的核外电子排布式为[Ar]_
您最近一年使用:0次
9 . 乙酸脱水可以形成乙酸酐。早在1853年,弗雷德里克·热拉尔就用乙酸酐与水杨酸合成了乙酰水杨酸(阿司匹林)。

(1)水杨酸中的含氧官能团为___________。
(2)阿司匹林可看成为酯类物质,则1mol阿司匹林与足量NaOH溶液完全反应需要NaOH___________mol。
(3)写出水杨酸与碳酸氢钠反应的化学方程式___________ 。
(4)阿司匹林药品需要保存在干燥处,受潮的药品易变质不宜服用,请从有机物结构的角度分析阿司匹林易变质的原因___________ ;检验受潮药片是否变质的试剂是___________ 。

(1)水杨酸中的含氧官能团为___________。
| A.酚羟基 | B.醇羟基 | C.酯基 | D.羧基 |
(2)阿司匹林可看成为酯类物质,则1mol阿司匹林与足量NaOH溶液完全反应需要NaOH___________mol。
| A.1 | B.1.5 | C.2 | D.3 |
(3)写出水杨酸与碳酸氢钠反应的化学方程式
(4)阿司匹林药品需要保存在干燥处,受潮的药品易变质不宜服用,请从有机物结构的角度分析阿司匹林易变质的原因
您最近一年使用:0次
10 . A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
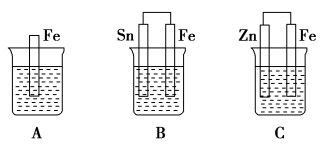
(1)A中反应的离子方程式为___________ 。
(2)B中锡极为________ 极,电极反应式为_________ ,锡极附近溶液的酸性_________ (填“增强”“减弱”或“不变”)。B中Fe极为________ 极,电极反应式为_________ 。
(3)C中被氧化的金属是___________ ,总反应的化学方程式为___________ 。
(4)A、B、C中铁被氧化由快到慢的顺序是___________ 。

(1)A中反应的离子方程式为
(2)B中锡极为
(3)C中被氧化的金属是
(4)A、B、C中铁被氧化由快到慢的顺序是
您最近一年使用:0次



