23-24高二下·全国·期末
解题方法
1 . 钛(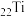 )及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
)及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下: 原子的价电子轨道表示式为
原子的价电子轨道表示式为___________ 。
(2)纳米 可作为以下反应的催化剂:
可作为以下反应的催化剂: 的原子有
的原子有___________ (填元素符号,下同),其中第一电离能最大的是___________ 。
②某有机物与化合物甲互为同分异构体,能与 溶液反应,且与银氨溶液共热会产生银镜,其结构简式为
溶液反应,且与银氨溶液共热会产生银镜,其结构简式为___________ (写一种)。
(3)钙钛矿晶体立方晶胞结构如下图所示。
① 位于立方晶胞的顶角,被
位于立方晶胞的顶角,被___________ 个O包围成配位八面体。
②若A的分数坐标为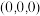 ,则B的分数坐标为
,则B的分数坐标为___________ 。
③钙钛矿晶体的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则钙钛矿晶胞的边长为
,则钙钛矿晶胞的边长为___________  。
。
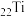 )及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
)及其合金大量用于航空工业,被誉为“空间金属”。一种制备金属钛的流程如下:
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)纳米
 可作为以下反应的催化剂:
可作为以下反应的催化剂:
 的原子有
的原子有②某有机物与化合物甲互为同分异构体,能与
 溶液反应,且与银氨溶液共热会产生银镜,其结构简式为
溶液反应,且与银氨溶液共热会产生银镜,其结构简式为(3)钙钛矿晶体立方晶胞结构如下图所示。

①
 位于立方晶胞的顶角,被
位于立方晶胞的顶角,被②若A的分数坐标为
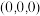 ,则B的分数坐标为
,则B的分数坐标为③钙钛矿晶体的密度为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则钙钛矿晶胞的边长为
,则钙钛矿晶胞的边长为 。
。
您最近一年使用:0次
23-24高二下·全国·期末
2 . 北京冬奥会的吉祥物“冰墩墩”摆件由环保聚氯乙烯(PVC)、ABS树脂、亚克力(PMMA)和聚碳酸酯(PC)等高分子材料制作而成,材质轻盈,形象深受人们的喜爱。 )在一定条件下合成聚氯乙烯的化学方程式:
)在一定条件下合成聚氯乙烯的化学方程式:______ 。
(2)ABS的结构如下所示: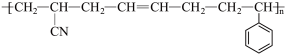
写出ABS对应单体的结构简式: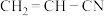 、
、__________ 、__________ 。
(3)亚克力(PMMA)的合成路线如下所示:__________ 。
②D的结构简式为__________ 。
③E→PMMA单体的化学方程式为__________ 。
(4)下图是聚碳酸酯(PC)的合成过程和分子结构片段。下列说法错误的是________ (填字母序号)。
b.反应物Ⅰ和Ⅱ的核磁氢谱中均有三组峰
c.生成物除聚碳酸酯外还有苯酚
d.通过化学方法可实现聚碳酸酯的降解
(5)PVC、ABS、PMMA和PC四种聚合物中属于缩聚产物的是__________ 。

 )在一定条件下合成聚氯乙烯的化学方程式:
)在一定条件下合成聚氯乙烯的化学方程式:(2)ABS的结构如下所示:
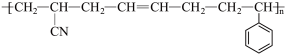
写出ABS对应单体的结构简式:
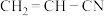 、
、(3)亚克力(PMMA)的合成路线如下所示:

已知: (R、
(R、 代表烃基)
代表烃基)
②D的结构简式为
③E→PMMA单体的化学方程式为
(4)下图是聚碳酸酯(PC)的合成过程和分子结构片段。下列说法错误的是

b.反应物Ⅰ和Ⅱ的核磁氢谱中均有三组峰
c.生成物除聚碳酸酯外还有苯酚
d.通过化学方法可实现聚碳酸酯的降解
(5)PVC、ABS、PMMA和PC四种聚合物中属于缩聚产物的是
您最近一年使用:0次
名校
解题方法
3 . 芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
(1)A的化学名称是___________ 。①和⑧的反应类型分别是___________ 、___________ 。
(2)D中含氧官能团名称是___________ ,E的结构简式为___________ 。
(3)反应②的化学方程式为___________ 。
(4)反应⑦的作用是___________ 。
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有___________ 种。
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)设计以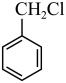 为起始原料制备
为起始原料制备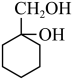 的合成路线
的合成路线________ 。(无机试剂和有机溶剂任用,合成路线示例见题干)
已知①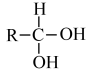
 RCHO;
RCHO;
②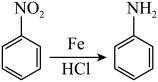 (苯胺,易被氧化)
(苯胺,易被氧化)
(1)A的化学名称是
(2)D中含氧官能团名称是
(3)反应②的化学方程式为
(4)反应⑦的作用是
(5)1molD与1molH2的加成产物同时满足下列条件的同分异构体有
①苯环上只有四种不同化学环境的氢原子;
②能与FeCl3发生显色反应;
③分子中只存在一个环不含其它环状结构。
(6)设计以
 为起始原料制备
为起始原料制备 的合成路线
的合成路线
您最近一年使用:0次
4 . 许多无机非金属材料含有硅元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。以下为制备高纯硅、氮化硅的主要工艺流程图: 沸点
沸点 ,且能与
,且能与 剧烈反应,并在空气中易自燃。
剧烈反应,并在空气中易自燃。
回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为__________ 。
(2)若用下图所示装置证明非金属性: ,从以下所给物质中选出合适的物质:①稀盐酸;②稀硫酸;③碳酸钠;④
,从以下所给物质中选出合适的物质:①稀盐酸;②稀硫酸;③碳酸钠;④ 溶液。试剂A为
溶液。试剂A为__________ (填序号,下同),试剂C为__________ 。 。若产物中硅与碳化硅的物质的量之比为
。若产物中硅与碳化硅的物质的量之比为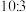 ,则参与反应的
,则参与反应的 和C的物质的量之比为
和C的物质的量之比为__________ 。
(4)该工艺中制备 的化学方程式为
的化学方程式为______________ 。
(5)若在实验室中完成 与过量
与过量 制备纯硅,其装置如图(热源及夹持装置已略去)。
制备纯硅,其装置如图(热源及夹持装置已略去)。__________ (填名称),实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的目的是______________ 。
(6)该工艺中制备氮化硅的同时会生成一种可燃性有毒气体,反应⑤的化学方程式为________________ 。
(7)上述制备高纯硅、氮化硅的工艺流程中可以循环利用的物质是__________ (填化学式)。

 沸点
沸点 ,且能与
,且能与 剧烈反应,并在空气中易自燃。
剧烈反应,并在空气中易自燃。回答下列问题:
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)若用下图所示装置证明非金属性:
 ,从以下所给物质中选出合适的物质:①稀盐酸;②稀硫酸;③碳酸钠;④
,从以下所给物质中选出合适的物质:①稀盐酸;②稀硫酸;③碳酸钠;④ 溶液。试剂A为
溶液。试剂A为
 。若产物中硅与碳化硅的物质的量之比为
。若产物中硅与碳化硅的物质的量之比为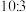 ,则参与反应的
,则参与反应的 和C的物质的量之比为
和C的物质的量之比为(4)该工艺中制备
 的化学方程式为
的化学方程式为(5)若在实验室中完成
 与过量
与过量 制备纯硅,其装置如图(热源及夹持装置已略去)。
制备纯硅,其装置如图(热源及夹持装置已略去)。
(6)该工艺中制备氮化硅的同时会生成一种可燃性有毒气体,反应⑤的化学方程式为
(7)上述制备高纯硅、氮化硅的工艺流程中可以循环利用的物质是
您最近一年使用:0次
2024-06-07更新
|
275次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
名校
5 . 如图所示,某同学利用 和70%的
和70%的 溶液制取
溶液制取 并探究其性质。
并探究其性质。___________ ;装置B中发生反应的现象为___________ 。
(2)装置C中的实验现象是___________ ,该实验现象说明 具有
具有___________ (填“氧化”或“还原”)性。
(3)装置D的实验现象是___________ 。
(4)装置E的目的是探究 与品红作用的可逆性,请写出实验操作及现象:
与品红作用的可逆性,请写出实验操作及现象:___________ 。
 和70%的
和70%的 溶液制取
溶液制取 并探究其性质。
并探究其性质。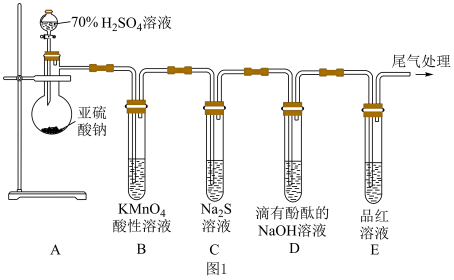
(2)装置C中的实验现象是
 具有
具有(3)装置D的实验现象是
(4)装置E的目的是探究
 与品红作用的可逆性,请写出实验操作及现象:
与品红作用的可逆性,请写出实验操作及现象:
您最近一年使用:0次
2024-06-07更新
|
126次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
6 . 氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组为了制取并探究氨气的性质,用下列装置(部分夹持装置已略去)进行实验。 装置,则该反应的化学方程式为
装置,则该反应的化学方程式为___________ 。
(2)B装置中的干燥剂可选用___________ (填名称)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是___________ (填“C”或“D”)装置。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________ ,发生该反应的化学方程式为___________ 。
(5)F装置中倒置漏斗的作用是___________ ,与F有相同作用的装置为___________ (填序号)。
(6)氨的用途很广,如:①用氨处理二氧化氮: ,该反应中氨体现
,该反应中氨体现___________ (填“氧化性”或“还原性”);②工业上用氨气制硝酸,首先将氨气催化氧化,写出氨气催化氧化的化学方程式___________ 。
(7)氨气极易溶于水,会形成喷泉实验,实验装置如图所示。下列可以产生类似现象的组合为___________ 。

 装置,则该反应的化学方程式为
装置,则该反应的化学方程式为(2)B装置中的干燥剂可选用
(3)气体通过C、D装置时,试纸颜色会发生变化的是
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)F装置中倒置漏斗的作用是
|
|
|
| Ⅰ | Ⅱ | Ⅲ |
(6)氨的用途很广,如:①用氨处理二氧化氮:
 ,该反应中氨体现
,该反应中氨体现(7)氨气极易溶于水,会形成喷泉实验,实验装置如图所示。下列可以产生类似现象的组合为

| 圆底烧瓶(干燥气体) | 烧杯及胶头滴管(液体) | |
| A | NO | 水 |
| B |  | 4mol/L NaOH溶液 |
| C |  | 饱和NaCl溶液 |
| D |  | 1mol/L盐酸 |
您最近一年使用:0次
2024-06-05更新
|
207次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
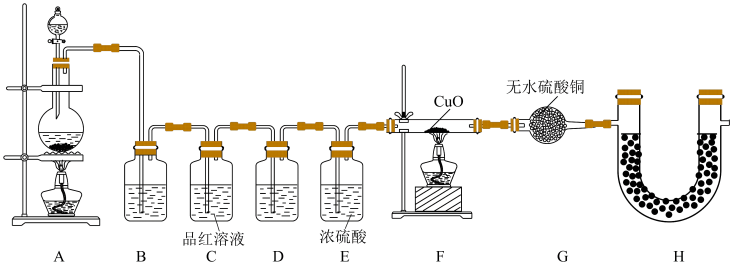
7 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(含碳元素)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为_____ 和______ ,原因是________ (用化学方程式表示)。
(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究:_______ ,装置C中品红溶液的作用是________ 。
②装置D中加入的试剂为________ 。
③装置G中可能出现的现象为__________ 。
④装置H的作用为______________ 。
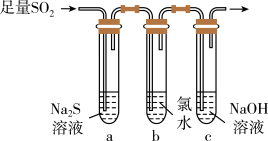
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。_________ 。
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成;
上述方案中合理的是____ (填 “Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为_______ 。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究:
②装置D中加入的试剂为
③装置G中可能出现的现象为
④装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成;
上述方案中合理的是
您最近一年使用:0次
2024-05-27更新
|
284次组卷
|
2卷引用:名校期末好题汇编-非金属元素(非选择题)
名校
解题方法
8 . 甲烷是重要的燃料和化工原料,一种利用CO2制备CH4的反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:___________ ;5~10min内,用H2O(g)表示的平均反应速率v(H2O)=___________ mol/(L·min);下列措施能加快上述反应的正反应速率的是___________ (填标号)。
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是___________ (填标号);反应达到平衡时,H2的转化率为___________ ,平衡时的压强与初始压强的比值为___________ (填最简整数比)。
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
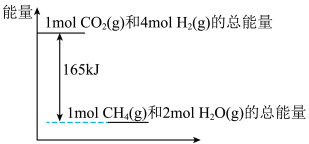
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗___________ L(换算成标准状况下)H2,生成___________ gCH4。
 CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题: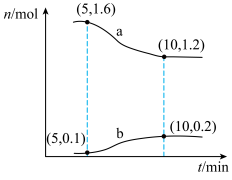
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗
您最近一年使用:0次
2024-05-10更新
|
334次组卷
|
3卷引用:期末检测卷02-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
(已下线)期末检测卷02-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)河北省石家庄市第十五中学2023-2024学年高一下学期期中考试化学试题河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期5月月考化学试题
名校
解题方法
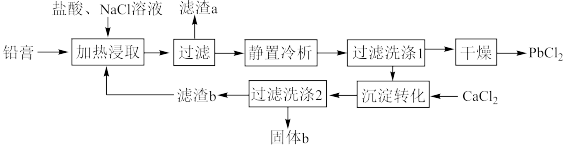
9 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
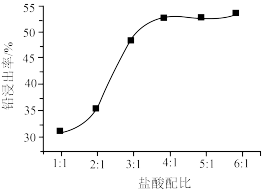
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
10 . 某化学兴趣小组在教师的指导下,利用如图所示装置(夹持和加热装置已省略)和试剂进行NH3的制备及性质探究的一体化实验。请回答下列问题:___________ ;乙处瓶内观察到的现象为___________ ;丙处烧杯中的试剂为稀硫酸,丙处球形干燥管的作用是___________ 。
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为___________ ;继续反应一段时间后,关闭K2、K4,打开K3,挤压胶头滴管,己处圆底烧瓶内能观察到的现象为___________ 。
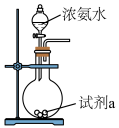
(3)甲装置可以用如图所示装置代替,试剂a可选择___________ (填试剂名称)。氨的催化氧化是工业制硝酸的基础,氨与氧气在催化剂作用下发生反应生成氮的氧化物时,氧化剂和还原剂的物质的量之比为___________ 。
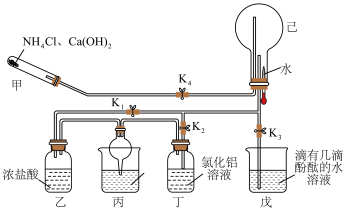
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为
(3)甲装置可以用如图所示装置代替,试剂a可选择
您最近一年使用:0次






