解题方法
1 . 实验室用苯和液溴制取溴苯并验证其反应类型的实验装置图(夹持装置略)及有关数据如下,按下列步骤回答有关问题。
_______ 。
(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4mL液态溴,向a中滴入液溴,有白雾生成,a中发生反应的化学方程式为_______ 。
(3)d中CCl4的作用是_______ ;e中出现_______ ,则说明苯与液溴发生了取代反应。
(4)充分反应后,经过下列步骤分离提纯。
①反应后a瓶中的溴苯因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴依次用水、_______ 溶液、水洗涤。
②向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是_______ 。
③已知苯与溴还可能发生副反应生成对二溴苯(沸点 和邻二溴苯(沸点
和邻二溴苯(沸点 要进一步提纯,再进行
要进一步提纯,再进行_______ (填操作名称)即可得到较纯净的溴苯,该过程中为了受热均匀和易于控制温度,可采用_______ (填“水浴”或“油浴”)加热。
| 苯 | 溴 | 溴苯 | |
| 密度/(g·cm⁻³) | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解性 | 微溶 | 微溶 | 微溶 |

(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4mL液态溴,向a中滴入液溴,有白雾生成,a中发生反应的化学方程式为
(3)d中CCl4的作用是
(4)充分反应后,经过下列步骤分离提纯。
①反应后a瓶中的溴苯因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴依次用水、
②向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是
③已知苯与溴还可能发生副反应生成对二溴苯(沸点
 和邻二溴苯(沸点
和邻二溴苯(沸点 要进一步提纯,再进行
要进一步提纯,再进行
您最近一年使用:0次
解题方法
2 . 过渡金属及其化合物在生产、生活中有重要的应用。回答下列问题:
I.元素周期表中的两种元素,其中X2+的3d轨道中有10个电子;Y单质在金属活动性顺序中排在最末位。
(1)写出X的基态原子的价电子排布式:_______ 。
(2)CN-常作为配位化合物中的配体。在CN-中,C原子采取_______ 杂化,C与N形成的化学键中含有的σ键与π键的数目之比为_______ 。
(3)X、Y均能与CN⁻形成配离子,已知X2+与CN⁻形成配离子时,配位数为4;Y+与CN-形成配离子时,配位数为2。工业上常用Y+和CN-形成的配离子与X单质反应,生成X2+与CN-形成的配离子和Y单质来提取Y,写出上述反应的离子方程式:_______ 。
Ⅱ.超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个(C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。______ 个。
(5)该超分子中配体p-甲酸丁酯吡啶提供孤电子对的原子是_______ (填元素符号)。
(6)C60晶体中,分子的堆积方式为_______ ;“杯酚”可以识别C60,“杯酚”与C60之间作用力的名称为_______ 。
I.元素周期表中的两种元素,其中X2+的3d轨道中有10个电子;Y单质在金属活动性顺序中排在最末位。
(1)写出X的基态原子的价电子排布式:
(2)CN-常作为配位化合物中的配体。在CN-中,C原子采取
(3)X、Y均能与CN⁻形成配离子,已知X2+与CN⁻形成配离子时,配位数为4;Y+与CN-形成配离子时,配位数为2。工业上常用Y+和CN-形成的配离子与X单质反应,生成X2+与CN-形成的配离子和Y单质来提取Y,写出上述反应的离子方程式:
Ⅱ.超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个(C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

(5)该超分子中配体p-甲酸丁酯吡啶提供孤电子对的原子是
(6)C60晶体中,分子的堆积方式为
您最近一年使用:0次
3 . 有机物在生产生活中应用广泛,某实验小组以“有机物结构的测定方法”和“配合物结构的测定方法”为研究课题设计了如下实验。
I.有机物结构的确定方法
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
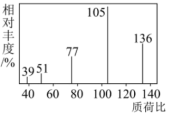
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是___________ 。
(2)由上述已知条件可推出有机物A的分子式为___________ 。
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:___________ 。
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如: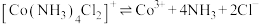 。
。
②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代 离子中NH3制得配合物
离子中NH3制得配合物 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。
实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为___________ 原子(填原子符号)。
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为___________ mol。
(6)为了减小实验误差,上述中和滴定实验应选择___________ (填“甲基橙”或“酚酞”)做指示剂。
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:___________ 。
I.有机物结构的确定方法
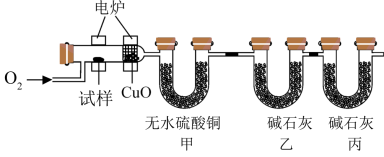
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是
(2)由上述已知条件可推出有机物A的分子式为
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:
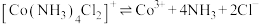 。
。②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代
 离子中NH3制得配合物
离子中NH3制得配合物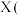 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为
(6)为了减小实验误差,上述中和滴定实验应选择
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:
您最近一年使用:0次
2024-05-04更新
|
338次组卷
|
3卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期4月期中考试化学试题
4 . 氨气在工农业生产中有重要应用。
(1)工业合成氨的化学方程式为___________ 。
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。___________ 。
②用装置B收集氨时,进气口是___________ (选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是___________ ,___________ 。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为___________ ,检验白烟中阳离子的方法是:取少量白烟于试管中,___________ 。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有___________ 和4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(1)工业合成氨的化学方程式为
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。
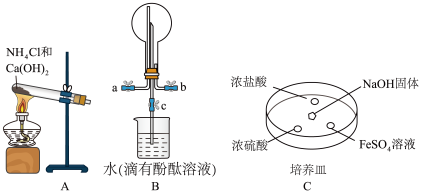
②用装置B收集氨时,进气口是
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
您最近一年使用:0次
2024-05-04更新
|
85次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
名校
解题方法
5 . 某校化学社团对铜与浓硫酸的反应进行相关研究。请回答下列问题:
(1)研究铜和浓硫酸反应的产物,实验装置如图所示。__________ 。
②铜与浓硫酸反应的化学方程式为__________ ,反应后试管中的溶液并未呈现蓝色而是几乎无色,请解释溶液不显蓝色的原因__________ 。
③若把氯气通入试管A、B、C、D中,其实验现象与上述现象不同的是__________ (选填A、B、C、D序号,气体颜色除外)。
(2)研究铜与浓硫酸反应时硫酸的最低浓度。甲组同学设计了方案一(实验装置如图一所示),乙组同学设计了方案二(实验装置如图二所示)。 能与
能与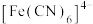 结合生成红棕色沉淀,可用于检验溶液中微量的
结合生成红棕色沉淀,可用于检验溶液中微量的 。
。
①甲组同学的方案是:在图一圆底烧瓶中放入少量的铜片和 溶液,通过仪器M缓慢、逐滴地加入
溶液,通过仪器M缓慢、逐滴地加入 浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为
浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为__________  (
( 不发生副反应,假设混合溶液体积为两溶液的体积之和)。
不发生副反应,假设混合溶液体积为两溶液的体积之和)。
②乙组同学在图二的圆底烧瓶中放入足量铜粉和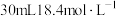 的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的
的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的 气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑
气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑 气体的逸出),再加入足量的
气体的逸出),再加入足量的 溶液,过滤、洗涤、干燥后称量沉淀的质量为
溶液,过滤、洗涤、干燥后称量沉淀的质量为 ,计算可得出该实验条件下能反应的硫酸浓度
,计算可得出该实验条件下能反应的硫酸浓度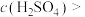
__________  (忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
(忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是__________ (用离子方程式表示)。
(1)研究铜和浓硫酸反应的产物,实验装置如图所示。

②铜与浓硫酸反应的化学方程式为
③若把氯气通入试管A、B、C、D中,其实验现象与上述现象不同的是
(2)研究铜与浓硫酸反应时硫酸的最低浓度。甲组同学设计了方案一(实验装置如图一所示),乙组同学设计了方案二(实验装置如图二所示)。
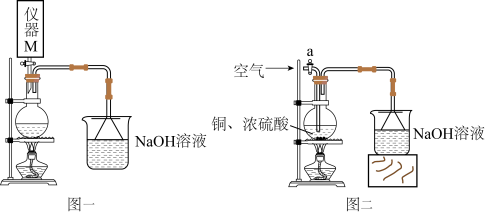
 能与
能与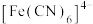 结合生成红棕色沉淀,可用于检验溶液中微量的
结合生成红棕色沉淀,可用于检验溶液中微量的 。
。①甲组同学的方案是:在图一圆底烧瓶中放入少量的铜片和
 溶液,通过仪器M缓慢、逐滴地加入
溶液,通过仪器M缓慢、逐滴地加入 浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为
浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为 (
( 不发生副反应,假设混合溶液体积为两溶液的体积之和)。
不发生副反应,假设混合溶液体积为两溶液的体积之和)。②乙组同学在图二的圆底烧瓶中放入足量铜粉和
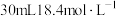 的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的
的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的 气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑
气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑 气体的逸出),再加入足量的
气体的逸出),再加入足量的 溶液,过滤、洗涤、干燥后称量沉淀的质量为
溶液,过滤、洗涤、干燥后称量沉淀的质量为 ,计算可得出该实验条件下能反应的硫酸浓度
,计算可得出该实验条件下能反应的硫酸浓度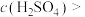
 (忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
(忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
您最近一年使用:0次
2024-05-03更新
|
95次组卷
|
3卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
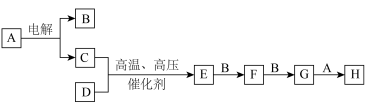
6 . 某些无机物的转化关系(部分反应物和生成物未列出)如图。已知化合物A为常见液体,气体E能使湿润的红色石蕊试纸变蓝。_____________ (填标号)。
a. b.
b.
(2)B、D在常温下难以发生反应,其主要原因为____________ 。
(3)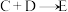 对人类的意义为
对人类的意义为_________________ (任写一点即可)。
(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:______________ ;试推测过量的E与氯气反应的现象:_____________ 。
(5)用 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:_________________ ,该反应中氧化产物与还原产物的物质的量之比为______________ 。
(6)常温常压下(气体摩尔体积为 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为______________  ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为_____________  (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
a.
 b.
b.
(2)B、D在常温下难以发生反应,其主要原因为
(3)
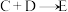 对人类的意义为
对人类的意义为(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:
(5)用
 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:(6)常温常压下(气体摩尔体积为
 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为 ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为 (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
您最近一年使用:0次
2024-05-03更新
|
70次组卷
|
3卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加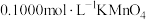 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗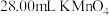 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: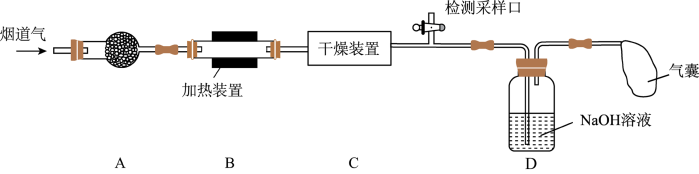
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: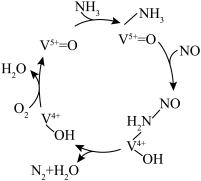
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: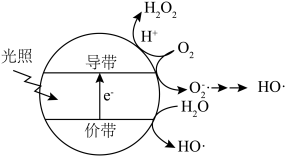
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加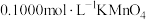 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗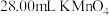 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
256次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
8 . 盐酸芬戈莫德(H)是一种治疗多发性硬化症的新型免疫抑制剂,以下是其中一种合成路线(部分反应条件已简化)___________ 个电子形成大 键。
键。
(2)由B生成C的反应类型为___________ ;G中官能团的名称为___________ 。
(3)试剂X的化学名称为___________ 。
(4)由D生成E的反应目的是___________ 。
(5)写出由A生成B的化学反应方程式___________ 。
(6)在C的同分异构体中,同时满足下列条件的可能结构共有___________ 种(不含立体异构)。
(a)含有苯环和硝基;
(b)核磁共振氢谱显示有四组峰,峰面积之比为 。
。
上述同分异构体中,硝基和苯环直接相连的结构简式为___________ 。
(7)参照上述反应路线,以 和
和 为原料,设计合成
为原料,设计合成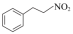 的路线(无机试剂任选)。
的路线(无机试剂任选)。___________ 。

已知:(i)
(ii)
 键。
键。(2)由B生成C的反应类型为
(3)试剂X的化学名称为
(4)由D生成E的反应目的是
(5)写出由A生成B的化学反应方程式
(6)在C的同分异构体中,同时满足下列条件的可能结构共有
(a)含有苯环和硝基;
(b)核磁共振氢谱显示有四组峰,峰面积之比为
 。
。上述同分异构体中,硝基和苯环直接相连的结构简式为
(7)参照上述反应路线,以
 和
和 为原料,设计合成
为原料,设计合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。
您最近一年使用:0次
2024-05-02更新
|
151次组卷
|
2卷引用:名校期中好题汇编-烃的衍生物(非选择题)
名校
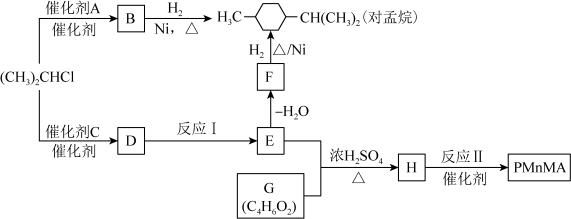
9 . 优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下。___________ 。
(2)B为芳香烃。
①(CH3)2CHCl与A反应生成B的化学方程式是___________ 。
②B的同系物中,相对分子质量最小的物质是___________ 。
(3)C的分子式是C7H8O,0.01mol C和浓溴水反应生成白色沉淀,完全反应时消耗0.03 mol Br2,E不能使Br2的CCl4溶液褪色。
①反应Ⅰ的化学方程式是___________ 。
②E→F的反应类型是___________ 。
(4)下列说法中正确的是(选填字母)___________ 。
a.B可使酸性高锰酸钾溶液褪色 b.D的酸性比E弱 c.E 的沸点高于对孟烷
(5)G中含有-COOH,其核磁共振氢谱有3种峰,峰面积之比为3︰2︰1。反应Ⅱ的化学方程式是___________ 。
已知:芳香化合物苯环上的H原子可以被卤代烷中的烷基取代。如: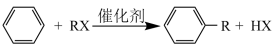 (R为烷基,X为卤原子)
(R为烷基,X为卤原子)
(2)B为芳香烃。
①(CH3)2CHCl与A反应生成B的化学方程式是
②B的同系物中,相对分子质量最小的物质是
(3)C的分子式是C7H8O,0.01mol C和浓溴水反应生成白色沉淀,完全反应时消耗0.03 mol Br2,E不能使Br2的CCl4溶液褪色。
①反应Ⅰ的化学方程式是
②E→F的反应类型是
(4)下列说法中正确的是(选填字母)
a.B可使酸性高锰酸钾溶液褪色 b.D的酸性比E弱 c.E 的沸点高于对孟烷
(5)G中含有-COOH,其核磁共振氢谱有3种峰,峰面积之比为3︰2︰1。反应Ⅱ的化学方程式是
您最近一年使用:0次
2024-05-01更新
|
175次组卷
|
2卷引用:北京师范大学第二附属中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
10 . 已知某芳香烃A的苯环上只有一个取代基,A核磁共报氢谱中存在一个代表3个 原子的吸收峰,且存在顺反异构。
原子的吸收峰,且存在顺反异构。 能发生如图所示的反应过程(某些反应条件略去,括号中的数字表示该有机物的相对分子质量)
能发生如图所示的反应过程(某些反应条件略去,括号中的数字表示该有机物的相对分子质量) 有多种同分异构体,其中属于芳香经且分子极性最小的一种的名称为
有多种同分异构体,其中属于芳香经且分子极性最小的一种的名称为___________ 。 的核磁共振氢谱中有
的核磁共振氢谱中有___________ 组吸收峰。
(2)按要求写出以下方程式,并回答问题:
①A发生聚合反应:___________ 。
② 与氢氧化钠溶液反应:
与氢氧化钠溶液反应:___________ 。
③ 的反应:
的反应:___________ ,该反应的反应类型为___________ 。
(3)有机物 是
是 的同系物且比
的同系物且比 多两个碳原子,符合要求的
多两个碳原子,符合要求的 有
有___________ 种(不考虑立体异构)。
(4)已知烯烃经臭氧氧化后,在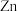 存在下水解,可得醛或酮。如:
存在下水解,可得醛或酮。如:___________ (写名称),该物质可以与水混溶,其可能的原因是___________ 。
②现有化学式为 的烃,它与氢气完全加成后得到
的烃,它与氢气完全加成后得到 ,它经臭氧氧化后,在
,它经臭氧氧化后,在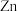 存在下水解生成如图两种有机物。则该烃的结构简式为
存在下水解生成如图两种有机物。则该烃的结构简式为___________ (不考虑立体异构)。
 原子的吸收峰,且存在顺反异构。
原子的吸收峰,且存在顺反异构。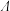 能发生如图所示的反应过程(某些反应条件略去,括号中的数字表示该有机物的相对分子质量)
能发生如图所示的反应过程(某些反应条件略去,括号中的数字表示该有机物的相对分子质量)
 有多种同分异构体,其中属于芳香经且分子极性最小的一种的名称为
有多种同分异构体,其中属于芳香经且分子极性最小的一种的名称为 的核磁共振氢谱中有
的核磁共振氢谱中有(2)按要求写出以下方程式,并回答问题:
①A发生聚合反应:
②
 与氢氧化钠溶液反应:
与氢氧化钠溶液反应:③
 的反应:
的反应:(3)有机物
 是
是 的同系物且比
的同系物且比 多两个碳原子,符合要求的
多两个碳原子,符合要求的 有
有(4)已知烯烃经臭氧氧化后,在
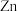 存在下水解,可得醛或酮。如:
存在下水解,可得醛或酮。如: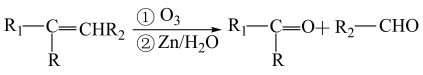
②现有化学式为
 的烃,它与氢气完全加成后得到
的烃,它与氢气完全加成后得到 ,它经臭氧氧化后,在
,它经臭氧氧化后,在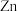 存在下水解生成如图两种有机物。则该烃的结构简式为
存在下水解生成如图两种有机物。则该烃的结构简式为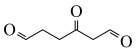
您最近一年使用:0次
2024-05-01更新
|
167次组卷
|
2卷引用:天津市南开中学2023-2024学年高二下学期期中考试化学试卷



