解题方法
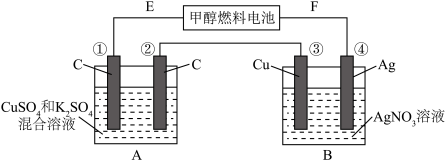
1 . (一).如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有3.2g甲醇参加反应且③电极增重(假设工作时无能量损失)。请回答下列问题:_______ ,E电极的反应方程式式:_______ 。
(2)④电极的反应式:_____ ,通电一段时间后B池pH____ (填“变大”“变小”“不变”)。
(3)若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,电解过程中A池中共收集到标准状况下的气体_______ L,①、③电极析出固体物质的量之比______ 。
(4)欲使A池通电后的溶液恢复至原状,可加入一种物质是_______ (写名称)。
(二)选择适宜的材料和试剂设计一个原电池,完成下列反应: Cu+ 2Ag+= Cu2++2Ag。
(5)负极材料:_______ ,正极材料:_______ ,电解质溶液:_______ 。
(6)写出电极反应式:正极:_______ ,负极:_______ 。
(7)原电池中电子从___ 极流出, 电解质溶液中阴离子流向____ 极(填写电极名称“正”或“负”)。
(2)④电极的反应式:
(3)若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,电解过程中A池中共收集到标准状况下的气体
(4)欲使A池通电后的溶液恢复至原状,可加入一种物质是
(二)选择适宜的材料和试剂设计一个原电池,完成下列反应: Cu+ 2Ag+= Cu2++2Ag。
(5)负极材料:
(6)写出电极反应式:正极:
(7)原电池中电子从
您最近一年使用:0次
解题方法
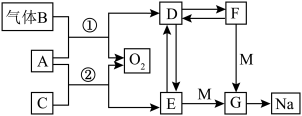
2 . A~G均代表常见化合物,且A、D、E、F、G均含同种金属阳离子,转化关系如图所示,C在常温下为液体,F俗称为小苏打,请回答下列问题:_______ ,F→D:_______ 。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为_______ 。
(3)请写出反应②的离子方程式:_____ ,该反应中的氧化剂与还原剂的质量之比为______ 。
(4)检验 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为_______ 。
(5)取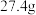 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重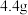 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为_______ ,原固体粉末中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为
(3)请写出反应②的离子方程式:
(4)检验
 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为(5)取
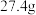 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重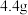 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为 的质量分数为
的质量分数为
您最近一年使用:0次
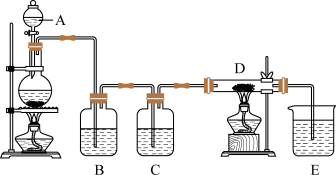
3 . 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(内置有铁粉)。请回答下列问题:_______ ,烧瓶中反应的化学方程式是_______ 。
(2)装置B中盛放的液体是_______ ,气体通过装置B的目的是_______ 。装置C中盛放的液体是_______ ,气体通过装置C的目的是_______ 。
(3)D中反应的化学方程式是_______ 。
(4)烧杯E中盛放的液体是_______ ,反应的离子方程式是_______ 。
(5)写出工业上用氯气和石灰乳制取漂白粉的化学方程式:_______ 。
(2)装置B中盛放的液体是
(3)D中反应的化学方程式是
(4)烧杯E中盛放的液体是
(5)写出工业上用氯气和石灰乳制取漂白粉的化学方程式:
您最近一年使用:0次
解题方法
4 . 某次实验需要用0.4mol/LNaOH溶液100mL。配制方法如下:
(1)配制该溶液应选用_______ mL容量瓶。
(2)托盘天平准确称量_______ g固体NaOH。
(3)将称量好的NaOH固体放入100mL大烧杯,倒入约20mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待_______ 后,将烧杯中的溶液注入容量瓶中。
(4)用少量蒸馏水洗涤烧杯2~3次,洗涤后的溶液_______ ,轻轻晃动容量瓶,使溶液混合均匀。
(5)向容量瓶加入蒸馏水,到液面距刻度线_______ 时,改用_______ 加蒸馏水至液面与刻度线相切。盖好瓶塞,反复摇匀。
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液浓度偏高的是_______ 和_______ ,(填序号),偏低的是_______ 和_______ ,对实验结果没有影响的是_______ (填序号)
A.所用的NaOH中混有少量的Na2CO3
B.配制溶液所用的容量瓶洗涤后没有烘干
C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶后,进行后面的操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定NaOH溶液体积(定容)时,俯视观察液面
(1)配制该溶液应选用
(2)托盘天平准确称量
(3)将称量好的NaOH固体放入100mL大烧杯,倒入约20mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待
(4)用少量蒸馏水洗涤烧杯2~3次,洗涤后的溶液
(5)向容量瓶加入蒸馏水,到液面距刻度线
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液浓度偏高的是
A.所用的NaOH中混有少量的Na2CO3
B.配制溶液所用的容量瓶洗涤后没有烘干
C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶后,进行后面的操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定NaOH溶液体积(定容)时,俯视观察液面
您最近一年使用:0次
5 . 用如图所示装置进行 与
与 反应的实验(夹持装置已略去):
反应的实验(夹持装置已略去):
(1)仪器a的名称为_______ 。
(2)装置Ⅳ中浓硫酸的作用为_______ 。
(3)装置Ⅲ中发生反应的化学方程式为_______ ,石棉绒的作用为_______ 。
(4)常温下,若将气体b缓慢通入盛有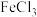 溶液的敞开试管中,一段时间后,观察到试管中颜色发生变化:
溶液的敞开试管中,一段时间后,观察到试管中颜色发生变化:
①写出上述溶液颜色发生变化时的离子方程式:_______ 。
②该反应中还原剂的总物质的量与氧化剂的总物质的量之比为_______ 。
 与
与 反应的实验(夹持装置已略去):
反应的实验(夹持装置已略去):
(1)仪器a的名称为
(2)装置Ⅳ中浓硫酸的作用为
(3)装置Ⅲ中发生反应的化学方程式为
(4)常温下,若将气体b缓慢通入盛有
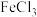 溶液的敞开试管中,一段时间后,观察到试管中颜色发生变化:
溶液的敞开试管中,一段时间后,观察到试管中颜色发生变化:①写出上述溶液颜色发生变化时的离子方程式:
②该反应中还原剂的总物质的量与氧化剂的总物质的量之比为
您最近一年使用:0次
6 . 回答下列问题
(1)有A、B、C、D、E五种元素,它们的核电荷数依次增大,A是元素周期表中原子半径最小的一种元素,B、C、D、E是连继相邻的四种元素,且均比A多一个电子层,其中E是元素周期表中非金属性最强的一种元素,按要求完成下列问题:
①这几种元素中电负性最大的是_______ (填元素符号,下同);
②B、C、D、E的第一电离能由小到大的顺序是_______ ;
③C的最高价氧化物对应的水化物和C的最低价氢物形成的化合物的化学式是_______ 。
(2)太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:
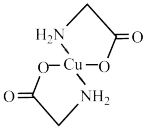
①硅原子电子占据的最高能级电子云形状为_______ ;
②Fe3+的价电子排布图为_______ ;
③铜位于周期表中_______ 区,铜原子的电子排布式为_______ 。试从核外电子排布角度比较,高温下Cu2O和CuO的稳定性更高的原因是_______ 。
(1)有A、B、C、D、E五种元素,它们的核电荷数依次增大,A是元素周期表中原子半径最小的一种元素,B、C、D、E是连继相邻的四种元素,且均比A多一个电子层,其中E是元素周期表中非金属性最强的一种元素,按要求完成下列问题:
①这几种元素中电负性最大的是
②B、C、D、E的第一电离能由小到大的顺序是
③C的最高价氧化物对应的水化物和C的最低价氢物形成的化合物的化学式是
(2)太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:

①硅原子电子占据的最高能级电子云形状为
②Fe3+的价电子排布图为
③铜位于周期表中
您最近一年使用:0次
7 . 现有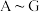 七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
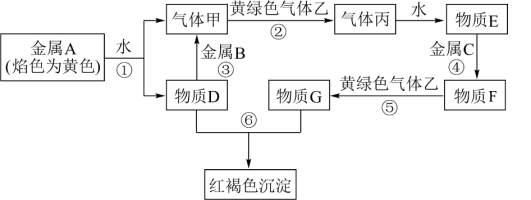
(1)写出下列物质的化学式:B___________ 、C___________ 。
(2)A物质在空气中燃烧的产物是___________ 色的粉末,该物质与 反应的方程式为
反应的方程式为___________ 。
(3)写出反应③的离子反应方程式:___________ 。
(4)在物质 中加入
中加入 溶液,现象为
溶液,现象为___________ ,发生反应的化学方程式为___________ 。
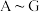 七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B
(2)A物质在空气中燃烧的产物是
 反应的方程式为
反应的方程式为(3)写出反应③的离子反应方程式:
(4)在物质
 中加入
中加入 溶液,现象为
溶液,现象为
您最近一年使用:0次
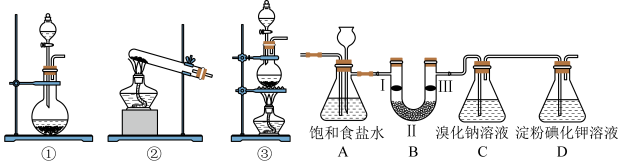
8 . 下图是某小组准备的制备氯气并进行一系列相关实验的部分装置(夹持设备已略)。
(1)实验室可以用 与浓盐酸反应制备氯气,则发生反应的离子方程式为
与浓盐酸反应制备氯气,则发生反应的离子方程式为___________ 。发生装置可选图中的___________ 装置(填序号)。
(2)依次连接好仪器后首先应进行的操作是___________ 。装置A中饱和食盐水的作用是___________ 。
(3)若要用装置B验证氯气是否具有漂白性,则B中I、II、III应依次放入___________ (填字母)。
(4)设计装置C、D的目的是比较氯、溴、碘单质的氧化性。当缓缓通入一定量氯气时,观察到C中___________ ,即可证明 氧化性大于Br2,其方程式为
氧化性大于Br2,其方程式为___________ 。
(5)小张同学认为不能由实验中观察到D装置中出现蓝色判定Br2的氧化性大于I2,理由是___________ 。
(6)小明认为该实验装置存在明显的缺陷,应进行的改进措施是___________ 。
(1)实验室可以用
 与浓盐酸反应制备氯气,则发生反应的离子方程式为
与浓盐酸反应制备氯气,则发生反应的离子方程式为(2)依次连接好仪器后首先应进行的操作是
(3)若要用装置B验证氯气是否具有漂白性,则B中I、II、III应依次放入
| 选项 | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置C、D的目的是比较氯、溴、碘单质的氧化性。当缓缓通入一定量氯气时,观察到C中
 氧化性大于Br2,其方程式为
氧化性大于Br2,其方程式为(5)小张同学认为不能由实验中观察到D装置中出现蓝色判定Br2的氧化性大于I2,理由是
(6)小明认为该实验装置存在明显的缺陷,应进行的改进措施是
您最近一年使用:0次
9 . 已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,F、G均能与L的水溶液反应放出B.据如图反应框图填空。

(1)F的俗名是_______ ,B分子式为 _______ ,工业上利用反应③生产 _______ 。(填名称)
(2)反应④的离子方程式为_______ 。
(3)有一种单质能与H反应生成E,该反应的化学方程式为_______ 。
(4)某酸性氧化物气体M溶于水具有漂白作用,既有氧化性,又有还原性,与D在溶液中反应的离子方程式为_______ 。

(1)F的俗名是
(2)反应④的离子方程式为
(3)有一种单质能与H反应生成E,该反应的化学方程式为
(4)某酸性氧化物气体M溶于水具有漂白作用,既有氧化性,又有还原性,与D在溶液中反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钙[ ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。

①已知: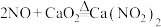 ;
;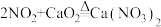 ;
;
②酸性条件下,NO能与 溶液反应生成
溶液反应生成 和
和 。
。
回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是___________ 。
(2)为达到实验目的,请把上述装置按气流方向进行连接:______
A→___________→B→___________→___________
(3)E装置的作用是___________ 。
(4)C装置中反应的离子方程式为___________ 。
(5)工业上可用石灰乳和硝酸工业的尾气(含 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为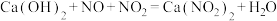 ,若
,若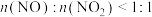 ,则会导致
,则会导致___________ 。
(6)将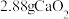 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为___________ mol。
 ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
①已知:
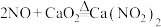 ;
;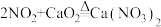 ;
;②酸性条件下,NO能与
 溶液反应生成
溶液反应生成 和
和 。
。回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间
 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是(2)为达到实验目的,请把上述装置按气流方向进行连接:
A→___________→B→___________→___________
(3)E装置的作用是
(4)C装置中反应的离子方程式为
(5)工业上可用石灰乳和硝酸工业的尾气(含
 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为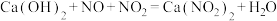 ,若
,若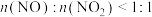 ,则会导致
,则会导致(6)将
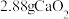 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为
您最近一年使用:0次
2024-03-15更新
|
595次组卷
|
3卷引用:陕西省西安铁一中学2023-2024学年高一上学期期末考试化学试题



