名校
1 . 氢叠氮酸( )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为
①氢叠氮酸在水溶液中的电离方程式为___________ 。
②0.1mol/L的 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为___________ 。
③已知T℃时,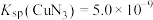 ,
, ,在此温度下,
,在此温度下,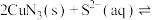
 ,该反应正反应方向
,该反应正反应方向___________ (填“能”或“不能”)基本进行彻底,请通过计算说明___________ 。
(2)在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
滴定终点的现象是___________ ,通过实验数据,计算该产品的纯度为___________ (用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
 )和莫尔盐
)和莫尔盐 是两种常用原料。
是两种常用原料。(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①氢叠氮酸在水溶液中的电离方程式为
②0.1mol/L的
 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为③已知T℃时,
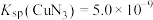 ,
, ,在此温度下,
,在此温度下,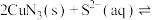
 ,该反应正反应方向
,该反应正反应方向(2)在
 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视读数,滴定结束后俯视读数
您最近一年使用:0次
解题方法
2 . 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式___________ ;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8 g KMnO4能和_____ mol HCl发生上述反应、产生的Cl2在标准状况下的体积为___________ L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为___________ mol;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:___________ ;
(1)①写出实验室中制取氯气的离子方程式
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8 g KMnO4能和
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:
您最近一年使用:0次
3 . 请完成下列填空:
(1)3.01×1023个氯气分子的物质的量是___ 。
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为___ ,各自所含有的原子数之比为____ 。
(3)3.1gNa2X含有Na+0.1mol,则Na2X的摩尔质量为___ 。
(4)23gNa与足量H2O反应,产生的气体在标准状况下的体积为___ 。
(1)3.01×1023个氯气分子的物质的量是
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为
(3)3.1gNa2X含有Na+0.1mol,则Na2X的摩尔质量为
(4)23gNa与足量H2O反应,产生的气体在标准状况下的体积为
您最近一年使用:0次
4 . 实验室常用KMnO4与浓盐酸反应来制备氯气:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,在此反应中:
(1)氧化剂是______ ,氧化产物是______ 。(填化学式)
(2)氧化剂与还原剂的物质的量之比为______ 。
(3)若生成71 g Cl2,则消耗的HCl是______ mol,被氧化的HCl是______ mol,转移的电子的物质的量是______ mol。
(4)将此反应改写成离子方程式______ 。
(1)氧化剂是
(2)氧化剂与还原剂的物质的量之比为
(3)若生成71 g Cl2,则消耗的HCl是
(4)将此反应改写成离子方程式
您最近一年使用:0次
2021-03-02更新
|
387次组卷
|
2卷引用:广东省汕尾市2020-2021学年高一上学期期末学业质量监测化学试题
5 . 有反应①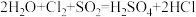 ,②
,②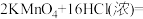
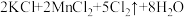 ,针对上述两个反应回答:
,针对上述两个反应回答:
(1)反应①中氧化剂和还原剂的质量比为_______ 。
(2)反应②中,在标准状况下有22.4L氯气生成时,转移电子的物质的量为_______ ,被氧化的氯化氢的质量为_______ 。
(3)上述两个反应中的还原剂的还原性强弱顺序为_______ 。
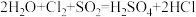 ,②
,②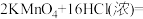
 ,针对上述两个反应回答:
,针对上述两个反应回答:(1)反应①中氧化剂和还原剂的质量比为
(2)反应②中,在标准状况下有22.4L氯气生成时,转移电子的物质的量为
(3)上述两个反应中的还原剂的还原性强弱顺序为
您最近一年使用:0次
解题方法
6 . 氯的单质及其化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1)常温下,可用氯酸钾固体与浓盐酸反应制备Cl2,写出反应的化学方程式___ ,若氧化产物比还原产物多1mol,则被氧化HCl的物质的量为___ mol。
(2)Cl2O为淡棕黄色气体,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___ 。
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,Cl2O的有效氯含量为___ 。(计算结果保留两位小数)
(1)常温下,可用氯酸钾固体与浓盐酸反应制备Cl2,写出反应的化学方程式
(2)Cl2O为淡棕黄色气体,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,Cl2O的有效氯含量为
您最近一年使用:0次
7 . 请按要求,回答下列问题:
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为____ 。
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为____
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为_____
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为
您最近一年使用:0次
2020-10-09更新
|
366次组卷
|
2卷引用:广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题
解题方法
8 . 把11.1 g铝镁合金的粉末放入200 mL某盐酸中,恰好完全反应并得到11.2 L H2(标准状况下)。试计算:
(1) 上述反应过程中,转移电子的物质的量______ 。
(2) 该合金中铝的质量分数______ 。
(1) 上述反应过程中,转移电子的物质的量
(2) 该合金中铝的质量分数
您最近一年使用:0次
解题方法
9 . 请完成下列计算:
(1)标准状况下,2.24LNH3的物质的量是__ mol,与__ g水中所含氢原子数相同。
(2)用10g烧碱配制成250mL溶液,其物质的量浓度为___ mol•L-1;从中取出10mL,其物质的量浓度为__ mol·L-1,含溶质__ g。
(1)标准状况下,2.24LNH3的物质的量是
(2)用10g烧碱配制成250mL溶液,其物质的量浓度为
您最近一年使用:0次
10 . 如图所示的原电池,电极材料是银和锌,电解质溶液是硫酸铜,一段时间后某极析出6.4克的固体。回答下列问题:
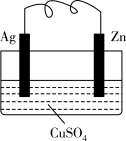
(1)正极是______ (填“锌”或“银),发生______ 反应;
(2)正极的电极反应式为______ ;
(3)上述过程中共需转移电子______ mol;
(4)锌片的质量减少了______ 克。

(1)正极是
(2)正极的电极反应式为
(3)上述过程中共需转移电子
(4)锌片的质量减少了
您最近一年使用:0次



