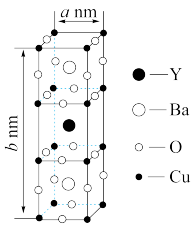
1 . 已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分别为a nm、bnm,阿伏加 德罗常数的值为NA。则该晶体的密度为________ g /cm3(列出计算式即可)。(原子量:Y-89 Ba-137 Cu-64 O-16)

您最近一年使用:0次
解题方法
2 . 常温下一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体A中和B所有可能的组合及其体积比___ 。
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式___ 。
(1)将该混合气体1L充分燃烧在同温、同压下得2.5LCO2,试推断原混合气体A中和B所有可能的组合及其体积比
(2)120℃时取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定混合气中各成分的分子式
您最近一年使用:0次
2019·广东广州·一模
解题方法
3 . 在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
(1)乙组实验中,盐酸_____________ (填“过量”、“适量”或“不足量”),理由是_________ 。
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是____ 。
(3)合金中Mg、Al的物质的量之比为_________________ 。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)_____________
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是
(3)合金中Mg、Al的物质的量之比为
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)
您最近一年使用:0次
2019·广东广州·一模
解题方法
4 . 将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
您最近一年使用:0次
解题方法
5 . 将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__ mLNaOH溶液时,可使溶解在硫酸中的Mg 和Al
和Al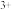 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
(1)当加入
 和Al
和Al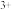 恰好完全沉淀。
恰好完全沉淀。(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
您最近一年使用:0次
6 . 臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________ ,每消耗1molO3,转移___ mole-。
(2)计算大气中臭氧的体积分数___ 。(写出计算过程)
(1)臭氧通入KI溶液中的化学方程式是
(2)计算大气中臭氧的体积分数
您最近一年使用:0次
7 . 将一定质量的铁粉加入装有100 mL某浓度稀硝酸的容器中充分反应。试回答:
(1)容器中剩余mg铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中溶质的化学式为__________ 。
②原稀硝酸的物质的量浓度为__________ 。
(2)向(1)中所得的固液混合物中逐滴滴加稀硫酸至刚好不再产生遇空气变成红棕色的气体为止,此时容器中剩余铁粉ng。
①此时溶液中溶质的化学式为__________ 。
②m-n的值为_______ (精确到0.1)。
(1)容器中剩余mg铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中溶质的化学式为
②原稀硝酸的物质的量浓度为
(2)向(1)中所得的固液混合物中逐滴滴加稀硫酸至刚好不再产生遇空气变成红棕色的气体为止,此时容器中剩余铁粉ng。
①此时溶液中溶质的化学式为
②m-n的值为
您最近一年使用:0次
2018-04-22更新
|
388次组卷
|
6卷引用:2019年广东省汕头市高三第一次模拟考试化学试题
2019年广东省汕头市高三第一次模拟考试化学试题2015-2016学年青海省平安县第一高中高一入学化学试卷2016-2017学年四川省资阳中学高一下学期3月月考化学试卷辽宁省六校协作体2017-2018学年高一下学期开学考试化学试题甘肃省武威市第六中学2017-2018学年高一下学期第一次学段考试(理)化学试题(已下线)3.3.3 硝酸的性质 人类活动对氮循环和环境的影响练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)
13-14高三上·广东中山·期末
8 . (1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
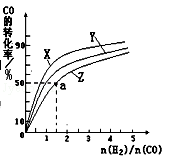
A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
C+ K2Cr2O7+ H2SO4 ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣116kJ•mol﹣1
①已知:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g) △H3=﹣484kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:

A)在上述三种温度中,曲线Z对应的温度是
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K= .(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L﹣1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
您最近一年使用:0次
9-10高一·浙江·阶段练习
9 . 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
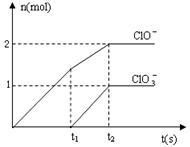
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:_________________________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后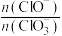
____ 2(填“>”、“<”或“=”);
若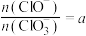 ,则n(C1-)=
,则n(C1-)=_________ mol(用含a的代数式来表示)。

(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:
(2)该石灰乳中含有Ca(OH)2的物质的量是
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后
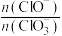
若
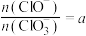 ,则n(C1-)=
,则n(C1-)=
您最近一年使用:0次
2013·广东湛江·一模
10 . 以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
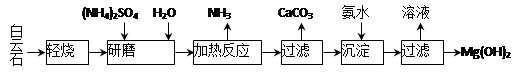
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
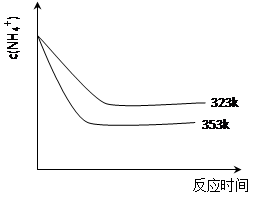
②由图可知,随着温度升高: 。
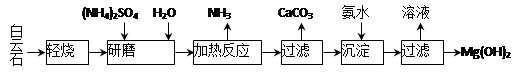
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
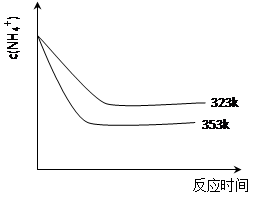
②由图可知,随着温度升高: 。
您最近一年使用:0次



