名校
解题方法
1 . 研究 CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g) CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________ ,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,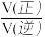 =
=____________ 。
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g)
 CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5.0 | 13.0 | 26.0 | 52.0 | ∞ |
| 气体总夺p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,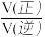 =
=
您最近一年使用:0次
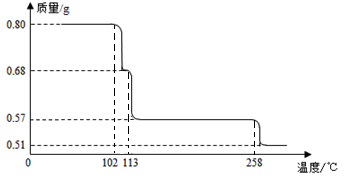
2 . 0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________ (要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________ 。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________ ,其存在的最高温度是_____________ ;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________ ;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________ mol·L-1。

请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
您最近一年使用:0次
2019-01-30更新
|
1972次组卷
|
5卷引用:2014陕西省西安铁一中、铁一中国际校高三下一模化学试卷
(已下线)2014陕西省西安铁一中、铁一中国际校高三下一模化学试卷(已下线)2012届陕西省兴平市秦岭中学高三上学期期末练习化学试卷2011年普通高等学校招生全国统一考试化学卷(新课标)2017届广东省华侨中学高三上学期摸底考试理综化学试卷黑龙江嫩江市高级中学2021届高三上学期第二次月考化学试题
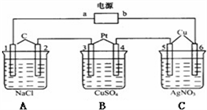
3 . 如图所示,通电5min后,电极5的质量增加2.16g。假设电解过程中溶液的体积不变。
请回答下列问题:
(1)电源中a是_______ 极。A池中阳极的电极反应式为___________ ,C池中阴极的电极反应式为___________________________ 。
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为___________________ 。
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为__________ 。

请回答下列问题:
(1)电源中a是
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为
您最近一年使用:0次
2012·陕西·一模
解题方法
4 . 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示。

试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______ 。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_______ 。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______ 0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=_______ 。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为_______ 。则上述转化的重要意义在于_______ 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于_______ 。(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)

试回答下列问题:
(1)试确定150℃时固体物质的化学式为
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于
您最近一年使用:0次
2014·陕西西安·模拟预测
5 . 一定条件下,在一固定容积的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
您最近一年使用:0次
6 . 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值。
(2)若反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时H2的物质的量。
 2NH3(g)。
2NH3(g)。(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值。
(2)若反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时H2的物质的量。
您最近一年使用:0次
2011·陕西·二模
7 . 2 g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(SO4)2溶液完全反应,反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5 Fe3+ +4H2O
(1) KMnO4溶液与混合物反应,消耗KMnO4的物质的量为 mol。
(2)欲配制500mL 0.1mol/L NH4+溶液,需称取 (NH4)2Fe(SO4)2·6H2O (M=392g/mol)的质量为 g。
(3)混合物中 Cu2S的质量分数为 。
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(SO4)2溶液完全反应,反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5 Fe3+ +4H2O
(1) KMnO4溶液与混合物反应,消耗KMnO4的物质的量为 mol。
(2)欲配制500mL 0.1mol/L NH4+溶液,需称取 (NH4)2Fe(SO4)2·6H2O (M=392g/mol)的质量为 g。
(3)混合物中 Cu2S的质量分数为 。
您最近一年使用:0次
11-12高二下·浙江金华·期中
8 . 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g) C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
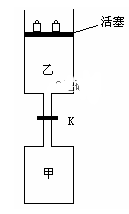
(1)乙中B的转化率为______________ ;
(2)甲中D和乙中C的物质的量比较:__________ (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为________ (用含V的代数式表示,连通管中气体体积忽略不计)。
 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为
(2)甲中D和乙中C的物质的量比较:
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
您最近一年使用:0次



