1 . 肼能除去锅炉用水中的溶解氧(即溶解的氧气),以减缓锅炉锈蚀。已知某锅炉用水中的溶解氧的浓度为8.0mg·L-1,若反应过程中肼全部转化为氮气,则每处理1m3该锅炉用水,需要消耗肼的质量为多少?______ (写出计算过程)。
您最近一年使用:0次
2 . 25℃时,醋酸电离平衡常数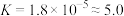 ,
,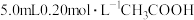 溶液与
溶液与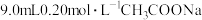 溶液混合均匀(混合后溶液体积不变)。请计算:
溶液混合均匀(混合后溶液体积不变)。请计算:
(1)求混合液的
_______ (保留2位有效数字,下同)。
(2)向混合液中加0.10mL(2滴) 盐酸,求此时溶液中
盐酸,求此时溶液中
_______  。(写出计算过程)
。(写出计算过程)
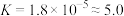 ,
,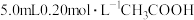 溶液与
溶液与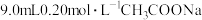 溶液混合均匀(混合后溶液体积不变)。请计算:
溶液混合均匀(混合后溶液体积不变)。请计算:(1)求混合液的

(2)向混合液中加0.10mL(2滴)
 盐酸,求此时溶液中
盐酸,求此时溶液中
 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
2021-05-16更新
|
425次组卷
|
2卷引用:上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题
名校
解题方法
3 . 工业硫酸中往往含有一定量SO2,测定过程如下:取m g工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用 c mol/L I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是__________ 。
您最近一年使用:0次
2010·上海·二模
4 . 过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为c mol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度___ 。
(2)通过计算确定过碳酸钠的化学式___ 。
(3)工业上常以所含活性氧的质量分数[w(活性氧)= ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品___ 。(已知:2Na2S2O3+I2→Na2S4O6+2NaI)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
(1)计算稀硫酸的物质的量浓度
(2)通过计算确定过碳酸钠的化学式
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
 ×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品
您最近一年使用:0次
2011·上海黄浦·一模
解题方法
5 . 使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第1支玻璃管中装有铜屑,第2支玻璃管中装有氧化铜,第1支玻璃管中由于发生如下反应:2PH3+Cu Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
(1)计算原混合气体中磷化氢和氢气的体积比___________________ 。
(2)在标准状况下,原混合气体的密度是___________________ ?
 Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。(1)计算原混合气体中磷化氢和氢气的体积比
(2)在标准状况下,原混合气体的密度是
您最近一年使用:0次
2010·上海奉贤·二模
解题方法
6 . 某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):2Cu2S+3O22Cu2O+2SO2,2Cu2O+Cu2S6Cu+SO2
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?___ (设杂质不参加反应)
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨___ (二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?(保留3位小数)
(3)今将amolCu2S与bmol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:___
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨
(3)今将amolCu2S与bmol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
| 反应后固体的成分 | Cu | Cu2S、Cu | Cu2O、Cu |
| b的取值范围 | |||
| P1与P2的关系(填>、<、=) | P1 P2 | P1 P2 | P1 P2 |
您最近一年使用:0次
2011·上海虹口·一模
7 . 将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL9mol/L的硝酸中,充分反应后,固体全部溶解,硝酸只被还原成NO2和NO(假设生成气体全部逸出),反应后溶液中H+为0.16mol(不考虑Cu2+的水解)。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数___ (保留2位小数)。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度___ (假设反应前溶液的体积不变)。
(3)生成NO2和NO气体的体积比___ 。
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O。现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气。
①最少应通入氧气的体积___ (标准状况)。
②参加反应的NaOH的物质的量。___
(1)铜片中单质铜的质量分数
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度
(3)生成NO2和NO气体的体积比
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O。现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气。
①最少应通入氧气的体积
②参加反应的NaOH的物质的量。
您最近一年使用:0次
2010·上海宝山·二模
解题方法
8 . 设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2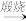 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______ %(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______ ,此时反应中SO2的转化率为_______ %(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______ m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________ 。
②试求x的值:________________
 2Fe2O3+8SO2
2Fe2O3+8SO2 (1)所得气体中SO2的体积分数不超过
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为
②试求x的值:
您最近一年使用:0次
2010·上海宝山·二模
解题方法
9 . CoCl2•xH2O与Na2CO3•10H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO3•10H2O的质量为_______ g(保留2位小数)。
(2)CoCl2•xH2O 中x=_____ 。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________ 。
(1)固体混合物中Na2CO3•10H2O的质量为
(2)CoCl2•xH2O 中x=
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为
您最近一年使用:0次
2012·上海徐汇·二模
解题方法
10 . 已知 NH3和 Cl2在常温下可快速反应生成氮气:2 NH3 + 3Cl2 → N2 + 6HCl。当 Cl2和 NH3 比例不同时,产物有差异。
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 Cl2 和 NH3 的最佳比例为____________ 。该反应可用于检验化工生产中氯气是否泄漏。如氯气有少量泄漏,用氨气检验时有明显现象,此过程中发生反应的Cl2和NH3的体积比范围为___________ 。
(2)体积为1.12 L,质量为3.335 g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672 L(其中Cl2体积分数为50%)(气体体积均为标准状况下测定)。则原混合气体中N2的体积为_____________ mL。
(3)根据第(2)题数据,计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
(4)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式(所有气体体积均在相同状况下测定)。______________
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 Cl2 和 NH3 的最佳比例为
(2)体积为1.12 L,质量为3.335 g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672 L(其中Cl2体积分数为50%)(气体体积均为标准状况下测定)。则原混合气体中N2的体积为
(3)根据第(2)题数据,计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
| 学生编号 | 所列第一步算式 | 未知数X表示的意义 |
| 甲 | 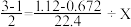 | |
| 乙 |  | |
(4)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式(所有气体体积均在相同状况下测定)。
您最近一年使用:0次



