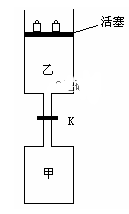
如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g)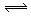 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为______________ ;
(2)甲中D和乙中C的物质的量比较:__________ (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为________ (用含V的代数式表示,连通管中气体体积忽略不计)。
 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为
(2)甲中D和乙中C的物质的量比较:
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
11-12高二下·浙江金华·期中 查看更多[5]
(已下线)2011-2012学年浙江省金华一中高二下学期期中考试化学试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013学年湖北省部分重点中学高二秋季期中联考化学试卷(已下线)2014陕西省交大附中高三第四次诊断化学试卷甘肃省镇原县第二中学2019届高三上学期第一次月考化学试题
更新时间:2012-08-30 14:14:27
|
【知识点】 化学反应进行的方向
相似题推荐
计算题
|
适中
(0.65)
解题方法
【推荐1】(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____ 。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
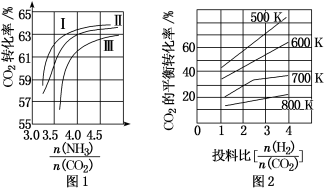
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[ ]和水碳比[
]和水碳比[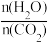 ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为____ 。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由_____ 。
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_____ 。
②该反应的ΔS___ 0,ΔH___ 0(填“>”或“<”)。
③700K投料比[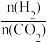 ]=2时,H2的平衡转化率为
]=2时,H2的平衡转化率为_____ 。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[ ]和水碳比[
]和水碳比[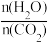 ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由

(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。①该反应的化学平衡常数的表达式为
②该反应的ΔS
③700K投料比[
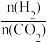 ]=2时,H2的平衡转化率为
]=2时,H2的平衡转化率为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】反应A(g) 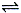 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
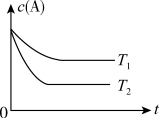
(1)上述反应的温度T1____ T2,平衡常数K(T1)____ K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________ 。
②反应的平衡常数K=_______ 。
③反应在0~5min区间的平均反应速率v(A)=________ 。
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______ 。
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____ 0(填“>”、“<”或“=”)。在______ 填“较高”或“较低”)温度下有利于该反应自发进行。
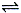 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为
②反应的平衡常数K=
③反应在0~5min区间的平均反应速率v(A)=
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2
 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS
您最近一年使用:0次



