(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:_____ 。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是_____
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol﹣1
CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣89.61 kJ•mol﹣1
写出白磷(P4)由Ca3(PO4)2、焦炭和SiO2在一定条件下反应的热化学方程式为:
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)△H(298.15 K)=﹣94.0 kJ•mol﹣1△S(298.15 K)=﹣75.8 J•mol﹣1•K﹣1,设△H和△S不随温度而变化,此反应自发进行的温度是
更新时间:2020-01-04 19:37:57
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】Ca、Pb均是重要的金属元素,在工农业失产中有着广泛的应用。
(1)加热条件下用CO还原PbO可得到单质Pb。已知:
①2Pb(s)+O2(g)=2PbO(s) △H=-438kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ•mol-1
则CO还原PbO的热化学方程式为___ 。
(2)与CaSO4•2H2O脱水反应相关的热化学方程式有
①CaSO4•2H2O(s)=CaSO4• H2O(s)+
H2O(s)+ H2O(g) △H=+83.2kJ•mol-1
H2O(g) △H=+83.2kJ•mol-1
②CaSO4•2H2O(s)=CaSO4(s)+2H2O(g) △H=+26kJ•mol-1
③CaSO4• H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ H2O(g) △H=+30.8kJ•mol-1
H2O(g) △H=+30.8kJ•mol-1
则该条件下H2O(g)=H2O(l)的△H=___ kJ•mol-1。
(3)在2000℃时,已知热化学方程式:
①CaO(s)+C(s)=Ca(s)+CO(g) △H1=akJ•mol-1
②Ca(s)+2C(s)=CaC2(s) △H2=bkJ•mol-1
③CaO(s)+CaC2(s)=3Ca(g)+2CO(g) △H3
则△H3=__ kJ•mol-1。(用含a、b的代数式表示)。
(4)目前工业上主要采用无焰氧化加热法合成电石。
已知:CaO(s)+3C(s)=CaC2(g)+CO(g) △H=+464.1kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ•mol-1
O2(g)=CO(g) △H=-110.5kJ•mol-1
若不考虑热量耗散,原料转化率均为100%,最终炉中出来的气体只有CO,则为了维持热平衡,每生产1molCaC2,投料的量为1molCaO、__ molC及__ molO2。
(1)加热条件下用CO还原PbO可得到单质Pb。已知:
①2Pb(s)+O2(g)=2PbO(s) △H=-438kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ•mol-1
则CO还原PbO的热化学方程式为
(2)与CaSO4•2H2O脱水反应相关的热化学方程式有
①CaSO4•2H2O(s)=CaSO4•
 H2O(s)+
H2O(s)+ H2O(g) △H=+83.2kJ•mol-1
H2O(g) △H=+83.2kJ•mol-1②CaSO4•2H2O(s)=CaSO4(s)+2H2O(g) △H=+26kJ•mol-1
③CaSO4•
 H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ H2O(g) △H=+30.8kJ•mol-1
H2O(g) △H=+30.8kJ•mol-1则该条件下H2O(g)=H2O(l)的△H=
(3)在2000℃时,已知热化学方程式:
①CaO(s)+C(s)=Ca(s)+CO(g) △H1=akJ•mol-1
②Ca(s)+2C(s)=CaC2(s) △H2=bkJ•mol-1
③CaO(s)+CaC2(s)=3Ca(g)+2CO(g) △H3
则△H3=
(4)目前工业上主要采用无焰氧化加热法合成电石。
已知:CaO(s)+3C(s)=CaC2(g)+CO(g) △H=+464.1kJ•mol-1
C(s)+
 O2(g)=CO(g) △H=-110.5kJ•mol-1
O2(g)=CO(g) △H=-110.5kJ•mol-1若不考虑热量耗散,原料转化率均为100%,最终炉中出来的气体只有CO,则为了维持热平衡,每生产1molCaC2,投料的量为1molCaO、
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】依据事实,写出下列反应的热化学方程式。
(1)0.25molC2H5OH完全燃烧生成液态水时放出341.7kJ热量,则表示C2H5OH燃烧热的热化学方程式。___________
(2)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1.该反应的热化学方程式是___________ 。
(3)已知①C4H10(g)=C4H8(g)+H2(g) ΔH1
②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为___________ kJ·mol-1。
(4)已知化学反应N2+3H2 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
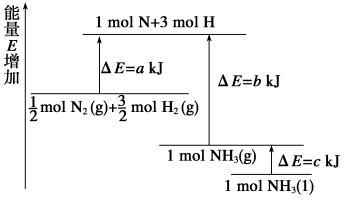
①1 mol N和3 mol H生成1 mol NH3(g)是___________ 能量的过程(填“吸收”或“释放”)。由 mol N2(g)和
mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程
mol H2(g)生成1 mol NH3(g)过程___________ (填“吸收”或“释放”)能量。
② mol N2(g)和
mol N2(g)和 mol H2(g)反应生成1 mol NH3(l)的△H =
mol H2(g)反应生成1 mol NH3(l)的△H = ___________
(1)0.25molC2H5OH完全燃烧生成液态水时放出341.7kJ热量,则表示C2H5OH燃烧热的热化学方程式。
(2)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1.该反应的热化学方程式是
(3)已知①C4H10(g)=C4H8(g)+H2(g) ΔH1
②C4H10(g)+
 O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1③H2(g)+
 O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1反应①的ΔH1为
(4)已知化学反应N2+3H2
 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
①1 mol N和3 mol H生成1 mol NH3(g)是
 mol N2(g)和
mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程
mol H2(g)生成1 mol NH3(g)过程②
 mol N2(g)和
mol N2(g)和 mol H2(g)反应生成1 mol NH3(l)的△H =
mol H2(g)反应生成1 mol NH3(l)的△H =
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0,下列各项能说明该反应已经达到平衡状态的是______
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1 mol N≡N键的同时,生成6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=_____ kJ·mol-1
(3)已知两个热化学方程式
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1 mol N≡N键的同时,生成6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=
(3)已知两个热化学方程式
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】(1)已知在 、
、 时,反应
时,反应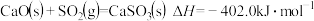 ,
,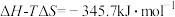 ,若该反应的
,若该反应的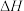 和
和 不随温度变化而变化,则保持该反应能自发进行的温度应低于
不随温度变化而变化,则保持该反应能自发进行的温度应低于_______ (结果保留整数)。
(2)已知: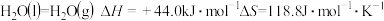 ,则水的沸点是
,则水的沸点是_______ (结果保留1位小数)。
(3)已知在 时,由石墨转化为金刚石的反应的
时,由石墨转化为金刚石的反应的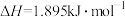 ,
,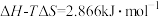 ,石墨的熵S石
,石墨的熵S石 ,则金刚石的熵S金=
,则金刚石的熵S金=________ ,这两种碳的同素异形体中更有序的是________ 。
 、
、 时,反应
时,反应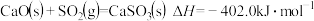 ,
,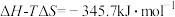 ,若该反应的
,若该反应的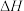 和
和 不随温度变化而变化,则保持该反应能自发进行的温度应低于
不随温度变化而变化,则保持该反应能自发进行的温度应低于(2)已知:
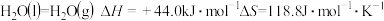 ,则水的沸点是
,则水的沸点是(3)已知在
 时,由石墨转化为金刚石的反应的
时,由石墨转化为金刚石的反应的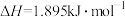 ,
,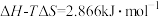 ,石墨的熵S石
,石墨的熵S石 ,则金刚石的熵S金=
,则金刚石的熵S金=
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】已知甲烷隔绝空气在不同温度下有可能发生如下两个反应:①CH4(g)=C(s)+2H2(g),②2CH4(g)=C2H2(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到了如下热力学数据:
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:___________ (填“高温”或“低温”)。
(2)通过计算判断①反应在常温下能否自发进行:___________ 。
(3)求算制取炭黑的允许温度范围:___________ 。
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
①的ΔH(298 K)=74.848 kJ·mol-1,ΔS(298 K)=80.674 J·mol-1·K-1
②的ΔH(298 K)=376.426 kJ·mol-1,ΔS(298 K)=220.211 J·mol-1·K-1
已知焓变和熵变随温度变化很小。请帮助这位同学考虑如下问题:
(1)判断②反应是高温自发还是低温自发:
(2)通过计算判断①反应在常温下能否自发进行:
(3)求算制取炭黑的允许温度范围:
(4)为了提高甲烷的碳化程度,你认为下面四个温度中最合适的是___________(填字母)。
| A.905.2 K | B.927 K |
| C.1 273 K | D.2 000 K |
您最近一年使用:0次



