解题方法
1 . 用 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
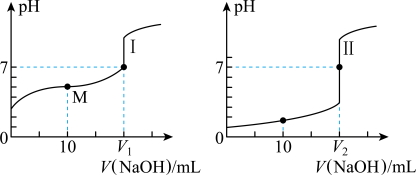
(1)用 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为______ (选填“酚酞”、“甲基橙”或“石蕊”),符合其滴定曲线的是______ (选填“Ⅰ”或“Ⅱ”)。
(2) 盐酸中,由水电离出的
盐酸中,由水电离出的
______  。
。
(3)图中 和
和 大小的比较:
大小的比较:
______ (选填“<”或“=”或“>”) 。
。
(4)在 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和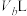 该
该 溶液。
溶液。
①若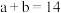 ,则
,则
______ (填数字)。
②若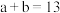 ,则
,则
______ (填数字)。
 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
(1)用
 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为(2)
 盐酸中,由水电离出的
盐酸中,由水电离出的
 。
。(3)图中
 和
和 大小的比较:
大小的比较:
 。
。(4)在
 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和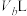 该
该 溶液。
溶液。①若
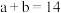 ,则
,则
②若
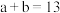 ,则
,则
您最近一年使用:0次
2 . 正常体温下,人体动脉血液的 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下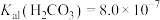 ,
,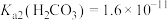 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)正常体温下,若某人动脉血 为
为 ,则属于
,则属于______ 中毒(选填“酸”或“碱”),他的血液中
______ 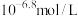 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(2)已知: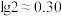 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中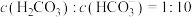 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。_____________________
 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下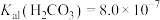 ,
,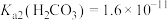 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)正常体温下,若某人动脉血
 为
为 ,则属于
,则属于
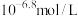 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(2)已知:
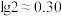 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中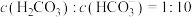 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。
您最近一年使用:0次
名校
3 . 向100mL含 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
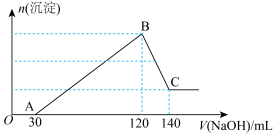
(1)写出OA段发生的离子方程式___________ ;
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为___________ :(保留一位小数)
(3)原溶液中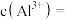
___________ ,
___________ ;
(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为 ,则x的值为多少?
,则x的值为多少?___________ (无计算过程不给分)。
 、
、 、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
、HCl的溶液中滴加一定浓度的NaOH溶液至过量,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。
(1)写出OA段发生的离子方程式
(2)依据表格中信息,计算滴加氢氧化钠溶液的物质的量浓度为
| 分子式:NaOH 相对分子质量:40 密度:  NaOH的质量分数:16.7% |
(3)原溶液中
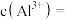

(4)将最终生成的沉淀过滤、洗涤、干燥后,放入坩埚中灼烧,得到的固体质量为4.9克。若灼烧后的固体为
 ,则x的值为多少?
,则x的值为多少?
您最近一年使用:0次
名校
解题方法
4 . Fe和 的混合物38.4g,加入
的混合物38.4g,加入 的盐酸,恰好完全溶解,再向其中加入KSCN溶液,未见血红色。
的盐酸,恰好完全溶解,再向其中加入KSCN溶液,未见血红色。
(1)发生反应的离子方程式有:___________ 。
(2)所得溶液中 的物质的量浓度为
的物质的量浓度为___________  (假设反应后溶液体积仍为200mL)。
(假设反应后溶液体积仍为200mL)。
(3) 的质量为多少克?
的质量为多少克?___________ (列出计算过程,此问无过程就无分)
(4)收集到气体在标准状况下的体积为___________ L。
 的混合物38.4g,加入
的混合物38.4g,加入 的盐酸,恰好完全溶解,再向其中加入KSCN溶液,未见血红色。
的盐酸,恰好完全溶解,再向其中加入KSCN溶液,未见血红色。(1)发生反应的离子方程式有:
(2)所得溶液中
 的物质的量浓度为
的物质的量浓度为 (假设反应后溶液体积仍为200mL)。
(假设反应后溶液体积仍为200mL)。(3)
 的质量为多少克?
的质量为多少克?(4)收集到气体在标准状况下的体积为
您最近一年使用:0次
5 . 把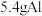 放入
放入 足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
(1)生成氢气在标准状况下的体积______________ 。
(2)反应后溶液中四羟基合铝酸钠的物质的量浓度______________ 。
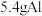 放入
放入 足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:
足量氢氧化钠溶液中完全反应,忽略溶液体积变化,试计算:(1)生成氢气在标准状况下的体积
(2)反应后溶液中四羟基合铝酸钠的物质的量浓度
您最近一年使用:0次
解题方法
6 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
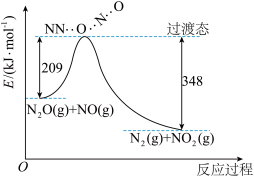
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次
名校
解题方法
7 . 用NaOH与 的混合物共28 g配制成100 mL溶液,测得该溶液中
的混合物共28 g配制成100 mL溶液,测得该溶液中 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
(1)原混合物中NaOH的质量分数______ %(保留一位小数)。
(2) 中的n值
中的n值______ 。
(3)盐酸的物质的量浓度______ 。
 的混合物共28 g配制成100 mL溶液,测得该溶液中
的混合物共28 g配制成100 mL溶液,测得该溶液中 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:(1)原混合物中NaOH的质量分数
(2)
 中的n值
中的n值(3)盐酸的物质的量浓度
您最近一年使用:0次
8 . t ℃时,将2mol A 和 6 mol B 充入容积固定为 2 L 的密闭容器中发生反应: A(g)+2B(g)  2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
(1)第 2 min 到第 4 min 内 A 的平均反应速率为_______
(2)t ℃时该反应的平衡常数为_______
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=_______ 。(写出三个题 完整计算过程,无计算过程不给分)
 2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:(1)第 2 min 到第 4 min 内 A 的平均反应速率为
(2)t ℃时该反应的平衡常数为
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=
您最近一年使用:0次
名校
解题方法
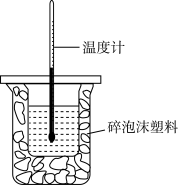
9 . Ⅰ、某实验小组用100mL0.55mol·L NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是___________ 。
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为___________ 。
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

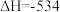 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:___________ 。
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为___________ kJ·mol 。
。
 NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

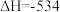 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol
 ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为 。
。
您最近一年使用:0次
2023-01-08更新
|
320次组卷
|
2卷引用:四川省遂宁中学校2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为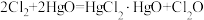 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:① 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②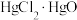 是难溶于水的固体。
是难溶于水的固体。
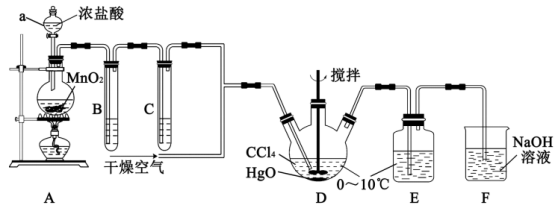
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片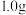 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入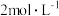 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知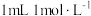 的硫代硫酸钠相当于
的硫代硫酸钠相当于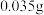 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为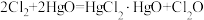 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
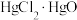 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
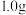 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入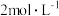 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知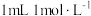 的硫代硫酸钠相当于
的硫代硫酸钠相当于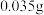 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次



