名校
解题方法
1 . Ⅰ.计算下列问题:
(1)50mL物质的量浓度为18mol·L-1的硫酸中加入足量铜片并加热,充分反应,被还原的H2SO4的物质的量为___________。
(2)将一定量的锌与100mL18.5mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中正确的是___________(填字母)。
Ⅱ.将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其 离子物质的量变化如下图所示,请回答下列问题:
离子物质的量变化如下图所示,请回答下列问题:___________ L。
(4)硝酸完全反应后消耗铜的物质的量n(Cu)是___________ mol。
(5)应再往此反应体系中滴加___________ mL 2 mol·L-1的硫酸才能使剩余的铜恰好完全溶解 (已知此过程中 的还原产物为NO)。
的还原产物为NO)。
(1)50mL物质的量浓度为18mol·L-1的硫酸中加入足量铜片并加热,充分反应,被还原的H2SO4的物质的量为___________。
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45 mol和0.9 mol之间 | D.大于0.45 mol |
(2)将一定量的锌与100mL18.5mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中正确的是___________(填字母)。
| A.气体A为SO2和H2的混合物 | B.气体A中SO2和H2的体积比为4∶1 |
| C.反应中共消耗Zn 97.5g | D.反应中共转移3mol电子 |
Ⅱ.将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其
 离子物质的量变化如下图所示,请回答下列问题:
离子物质的量变化如下图所示,请回答下列问题: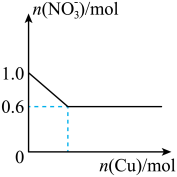
(4)硝酸完全反应后消耗铜的物质的量n(Cu)是
(5)应再往此反应体系中滴加
 的还原产物为NO)。
的还原产物为NO)。
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)已知: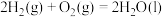
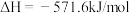

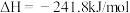
①则氢气的燃烧热
___________ ;
②计算

___________ ;
③计算1g氢气完全燃烧生成气态水时放出___________ kJ的热量。
(2)已知:①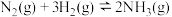
 ;
;
②
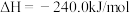 ;
;
③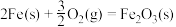
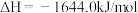 ;
;
则反应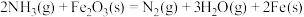

___________ 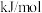 。
。
(1)已知:
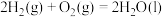
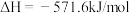

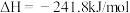
①则氢气的燃烧热

②计算


③计算1g氢气完全燃烧生成气态水时放出
(2)已知:①
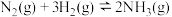
 ;
;②

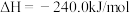 ;
;③
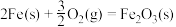
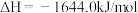 ;
;则反应
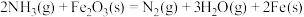

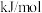 。
。
您最近一年使用:0次
名校
3 . 250mL 2mol/L 的H2SO4 与足量铁屑完全反应。写出必要的计算过程。计算:
(1)参加反应的铁屑的物质的量_____ 。
(2)生成的H2在标准状况下的体积_____ 。
(1)参加反应的铁屑的物质的量
(2)生成的H2在标准状况下的体积
您最近一年使用:0次
2024-01-28更新
|
95次组卷
|
2卷引用:四川省成都市成华区某校2023-2024学年高一上学期12月月考化学试题
名校
4 . 研究钠及其化合物的性质有重要的意义。
(1)金属钠非常活泼,通常保存在___________ 中,以隔绝空气。
(2)汽车安全气囊内装有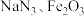 和
和 等物质。
等物质。
①当汽车发生严重碰撞时,引发 分解:
分解: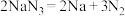 ,
, 中存在的化学键为
中存在的化学键为___________ ;若安全气囊内有 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为___________ L。
②产生的Na立即与 发生置换反应生成
发生置换反应生成 ,其中还原产物是
,其中还原产物是___________ 。
(3)某同学向 和
和 的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
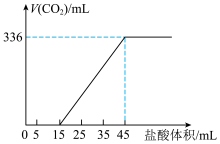
①混合液中
___________ 。
②盐酸的物质的量浓度为___________ 。
(1)金属钠非常活泼,通常保存在
(2)汽车安全气囊内装有
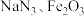 和
和 等物质。
等物质。①当汽车发生严重碰撞时,引发
 分解:
分解: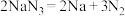 ,
, 中存在的化学键为
中存在的化学键为 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为②产生的Na立即与
 发生置换反应生成
发生置换反应生成 ,其中还原产物是
,其中还原产物是(3)某同学向
 和
和 的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
的混合液中逐滴加入一定浓度的盐酸,生成CO2的体积(标准状况)与加入盐酸的体积的关系如图所示。
①混合液中

②盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。
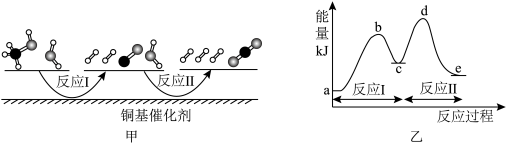
已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于_____ (填“增加”或“减少”)过程中的能耗,反应Ⅱ的热化学方程式为_____ 。
②该反应属于_____ (填“放热”或“吸热”)反应,请写出总反应的热化学方程式:_____ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:
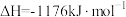 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为_____ 。
(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为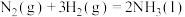

_____ 。
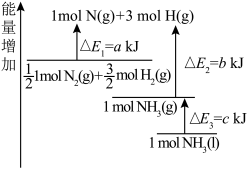
(4)下表是部分化学键的键能数据。
①已知1mol白磷完全燃烧生成固态 的反应热
的反应热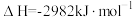 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
_____ 。
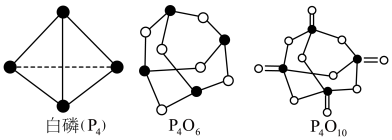
②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为_____ kJ。
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。

已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于
②该反应属于
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:

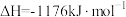 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为
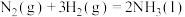


(4)下表是部分化学键的键能数据。
| 化学键 |  |  |  | 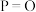 |
| 键能/(kJ·mol-1) | 198 | 360 | 498 |  |
 的反应热
的反应热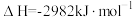 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中

②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为
您最近一年使用:0次
2023-10-27更新
|
300次组卷
|
3卷引用:四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题
6 . 完成下列问题。
(1)写出下列物理量的单位:物质的量_______ ,摩尔质量_______ ,气体摩尔体积_______ ,物质的量浓度_______ 。
计算:
(2)标况下,11.2LNH3的物质的量是_______ mol,质量是_______ g。0.5molNa2SO4中含_______ 个Na+。
(3)1mol 中含有质子的物质的量为
中含有质子的物质的量为_______ mol,含有电子的物质的量为_______ mol。
(4)100mL2mol/L的硫酸溶液溶质的物质的量为_______ mol。
(1)写出下列物理量的单位:物质的量
计算:
(2)标况下,11.2LNH3的物质的量是
(3)1mol
 中含有质子的物质的量为
中含有质子的物质的量为(4)100mL2mol/L的硫酸溶液溶质的物质的量为
您最近一年使用:0次
名校
解题方法
7 . 在某温度(T℃)的水溶液中,c(H+)=10xmol∙L-1,c(OH-)=10ymol∙L-1,x与y关系如图所示。
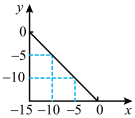
(1)该温度下,水的离子积为________ ,T℃_______ 25℃(填“>”“<”或“=”),纯水的pH________ 7(填“>”“<”或“=”)
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为________ 。(已知lg2=0.3)
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=_______ 。

(1)该温度下,水的离子积为
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=
您最近一年使用:0次
名校
解题方法
8 . 将20.0 g铜镁合金完全溶解于140 mL某浓度的硝酸中,得到NO2和NO的混合气体8.96 L(标准状况),当向反应后的溶液中加入320 mL 4.0 mol/L NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为37 g。通过计算回答下列问题:
(1)该合金中铜与镁的物质的量之比是_______ 。
(2)该硝酸中HNO3的物质的量浓度是_______ mol/L。
(3)NO2和NO的混合气体中,NO2的体积分数是_______ 。
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为_______ L。
(1)该合金中铜与镁的物质的量之比是
(2)该硝酸中HNO3的物质的量浓度是
(3)NO2和NO的混合气体中,NO2的体积分数是
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为
您最近一年使用:0次
名校
解题方法
9 . 现有一定量(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,加热使之充分反应,直至Ba(OH)2溶液过量。图甲表示产生沉淀的质量与加入Ba(OH)2溶液的体积之间的关系,图乙表示放出NH3的体积(标准状况下)与加入Ba(OH)2溶液的体积之间的关系(假设NH3全部放出)。

(1)混合溶液中NH 的物质的量为
的物质的量为_____ mol。
(2)混合溶液中NO 的物质的量为
的物质的量为_____ mol。
(3)当加入的Ba(OH)2溶液的体积在100~200mL之间时,发生反应的离子方程式为______ 。
(4)若向原混合溶液中一次性加入同浓度的Ba(OH)2溶液200mL,则发生反应的离子方程式为______ 。

(1)混合溶液中NH
 的物质的量为
的物质的量为(2)混合溶液中NO
 的物质的量为
的物质的量为(3)当加入的Ba(OH)2溶液的体积在100~200mL之间时,发生反应的离子方程式为
(4)若向原混合溶液中一次性加入同浓度的Ba(OH)2溶液200mL,则发生反应的离子方程式为
您最近一年使用:0次
2023-04-03更新
|
273次组卷
|
2卷引用:四川省资阳市乐至中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
10 . 常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)已知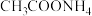 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤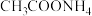 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是___________ (填序号)。
(2)Na2CO3溶液显碱性的原因___________ 。(用离子方程式表示)
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是_____ (填序号)。
(4)某温度下纯水的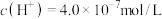 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使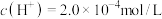 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的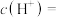
_______ 。
(5)25℃时,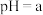 的
的 的
的 溶液与
溶液与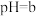 的
的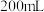 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系_______ 。
(6)向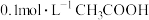 溶液中滴加
溶液中滴加 溶液至
溶液至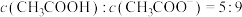 ,此时溶液
,此时溶液
_______ 。
(7)已知 的
的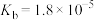 ,
, 的
的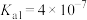 ,
,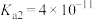 ,则反应
,则反应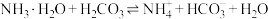 的平衡常数
的平衡常数
_______ 。
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
| 弱酸 |  |  |  |
| 电离平衡常数 | 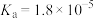 | 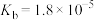 | 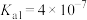 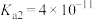 |
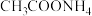 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤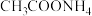 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是(2)Na2CO3溶液显碱性的原因
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是
(4)某温度下纯水的
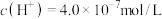 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使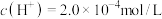 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的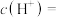
(5)25℃时,
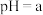 的
的 的
的 溶液与
溶液与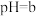 的
的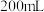 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系(6)向
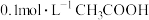 溶液中滴加
溶液中滴加 溶液至
溶液至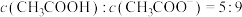 ,此时溶液
,此时溶液
(7)已知
 的
的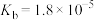 ,
, 的
的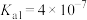 ,
,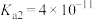 ,则反应
,则反应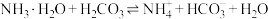 的平衡常数
的平衡常数
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
A. | B. | C.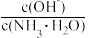 | D.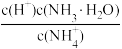 |
您最近一年使用:0次



