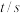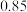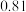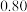名校
解题方法
1 . 某同学取未知浓度的硫酸铜溶液100 g,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示。试计算此硫酸铜溶液中溶质的质量分数___________ 。
您最近一年使用:0次
名校
解题方法
2 . 某实验小组用氯酸钾和二氧化锰为原料制取氧气,在试管中加入少量二氧化锰和适量氯酸钾,反应过程中测量的有关数据记录如下:
(1)反应到___________ min时,氯酸钾就完全分解。
(2)计算反应前氯酸钾的质量是多少?__________ (写出解题步骤)
| 反应时间(min) | 0 | 1 | 2 | 3 | 4 |
| 试管中固体质量(g) | 14.25 | 12.65 | 11.05 | 9.45 | 9.45 |
(2)计算反应前氯酸钾的质量是多少?
您最近一年使用:0次
3 . 硫氧粉(Na2SO3)可用作染漂脱氧剂,常因氧化变质生成Na2SO4。向18.4 g可能被氧化的样品中,加入质量分数为10%的稀硫酸至恰好不再产生气泡(假设气体全部逸出),消耗稀硫酸98 g。
已知: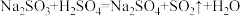 。
。
(1)三种钠盐:①Na2SO4、②Na2SO3、③Na2S2O3,其中含钠量由大到小的顺序是_______ (填序号)。
(2)求反应后溶液中溶质的质量分数(结果精确到0.1%)_______ 。(写出计算过程)
已知:
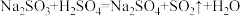 。
。(1)三种钠盐:①Na2SO4、②Na2SO3、③Na2S2O3,其中含钠量由大到小的顺序是
(2)求反应后溶液中溶质的质量分数(结果精确到0.1%)
您最近一年使用:0次
名校
解题方法
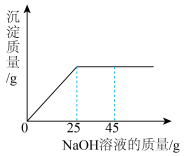
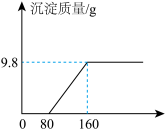
4 . 现有含CuSO4和H2SO4的混合溶液249.8 g,向其中加入10%的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量关系如图所示:_______ 。
(2)计算恰好完全反应时,所得溶液的溶质质量分数_____ 。(结果保留一位小数)
(2)计算恰好完全反应时,所得溶液的溶质质量分数
您最近一年使用:0次
2023-09-05更新
|
78次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高一上学期开学考试化学试题
名校
解题方法
5 . Ⅰ、某实验小组用100mL0.55mol·L NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
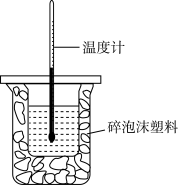
(1)回答下列问题:
①图中装置缺少的仪器是___________ 。
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为___________ 。
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

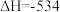 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:___________ 。
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为___________ kJ·mol 。
。
 NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

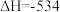 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol
 ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为 。
。
您最近一年使用:0次
2023-01-08更新
|
350次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2022-2023学年高二下学期开学考试化学试题
6 . 60.8g铁和氧化铁的混合物恰好能完全溶解在500mL 2mol/L稀硫酸中,向反应后的溶液中加入KSCN溶液,无明显现象。试求:
(1)混合物中铁元素的质量分数是多少?(计算结果保留一位小数)________
(2)反应过程中是否有氢气产生?若有,计算在标准状况下的体积是多少L,若无,通过计算说明理由。________
(1)混合物中铁元素的质量分数是多少?(计算结果保留一位小数)
(2)反应过程中是否有氢气产生?若有,计算在标准状况下的体积是多少L,若无,通过计算说明理由。
您最近一年使用:0次
7 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
420次组卷
|
2卷引用:四川省自贡市田家柄中学教育集团2021-2022学年高一下学期入学考试化学试题
名校
8 . 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。现有一包铁粉和铜粉的混合粉末17.6g,使其完全溶解恰好需要200mL3.0mol/L的FeCl3溶液。假设溶液反应前后体积不变,试计算:(注意:无计算过程不给分)
(1)混合粉末中铜的质量___________ ;
(2)反应后溶液中FeCl2的物质的量浓度___________ 。
(1)混合粉末中铜的质量
(2)反应后溶液中FeCl2的物质的量浓度
您最近一年使用:0次
名校
解题方法
9 . 将Fe2O3和Fe的混合物投入150 mL某浓度的稀硫酸中,收集到1.68 L H2(标准状况),同时Fe和Fe2O3均无剩余,且加入KSCN后溶液不显血红色,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,测得沉淀的质量为20.25 g,共消耗4 mol/L的NaOH溶液150 mL。(不考虑Fe(OH)2被氧化)
(1)原硫酸的物质的量浓度为_______ 。
(2)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=____ m(Fe)=_____ (无解题过程不给分)
(1)原硫酸的物质的量浓度为
(2)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=
您最近一年使用:0次
10 . 一定温度下,向 恒容容器中充入
恒容容器中充入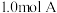 和
和 ,发生反应
,发生反应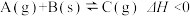 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前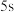 的平均反应速率
的平均反应速率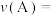
_______ ,达平衡时 的平衡体积分数为
的平衡体积分数为_______ 。
(2)由表中数据计算该温度下该反应的平衡常数为_______ ,随着反应温度升高,该反应的平衡常数_______ (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入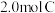 ,达平衡时,
,达平衡时, 的转化率为
的转化率为_______ 。
 恒容容器中充入
恒容容器中充入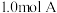 和
和 ,发生反应
,发生反应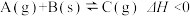 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
|
|
|
|
|
|
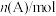 |
|
|
|
|
|
(1)前
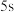 的平均反应速率
的平均反应速率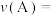
 的平衡体积分数为
的平衡体积分数为(2)由表中数据计算该温度下该反应的平衡常数为
(3)保持温度不变,起始时向容器中充入
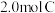 ,达平衡时,
,达平衡时, 的转化率为
的转化率为
您最近一年使用:0次
2021-02-03更新
|
244次组卷
|
2卷引用:四川省乐山市沫若中学2020-2021学年高二下学期入学考试化学试题