名校
1 . 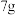 粗锌放在烧杯中,加入
粗锌放在烧杯中,加入 稀硫酸,待完全反应后(杂质与稀硫酸不反应,且不溶于水),称量,烧杯内物质总质量为
稀硫酸,待完全反应后(杂质与稀硫酸不反应,且不溶于水),称量,烧杯内物质总质量为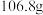 ,试计算反应后所得溶液的溶质质量分数(小数点后保留一位数字)
,试计算反应后所得溶液的溶质质量分数(小数点后保留一位数字)___________ 。
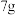 粗锌放在烧杯中,加入
粗锌放在烧杯中,加入 稀硫酸,待完全反应后(杂质与稀硫酸不反应,且不溶于水),称量,烧杯内物质总质量为
稀硫酸,待完全反应后(杂质与稀硫酸不反应,且不溶于水),称量,烧杯内物质总质量为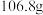 ,试计算反应后所得溶液的溶质质量分数(小数点后保留一位数字)
,试计算反应后所得溶液的溶质质量分数(小数点后保留一位数字)
您最近一年使用:0次
名校
2 . 已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______ 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
您最近一年使用:0次
3 . 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中还原剂是_______ ,氧化产物是 _______ 。
(2)若反应中有0.20mol 电子发生转移,生成氯气的体积为_______ (标准状况),被氧化的HCl的物质的量是_______ 。
(3)用“单线桥”法标出上述反应中电子转移的方向和数目:_____ 。
(1)该反应中还原剂是
(2)若反应中有0.20mol 电子发生转移,生成氯气的体积为
(3)用“单线桥”法标出上述反应中电子转移的方向和数目:
您最近一年使用:0次
名校
4 . 为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸50.0g,充分反应,产生CO2的质量,如表。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
求:
(1)样品Na2CO3和NaHCO3的质量之比____ 。
(2)盐酸的质量分数____ 。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的质量(g) | 1.32 | 1.65 | 1.76 | 1.32 |
求:
(1)样品Na2CO3和NaHCO3的质量之比
(2)盐酸的质量分数
您最近一年使用:0次
解题方法
5 . 在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如表(气体体积均为标准状况下测得):
(1)甲组实验中,盐酸_____ ;乙组实验中,盐酸_____ (填“过量“、“适量“或“不足“)。
(2)该盐酸的物质的量浓度_____ 。
(3)合金中Mg、Al的物质的量之比为____ 。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为 ,并使Mg2+刚好沉淀完全,则溶液中
,并使Mg2+刚好沉淀完全,则溶液中 的物质的量为
的物质的量为_____ mol;溶液中Na+的物质的量为______ mol。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 0.255 | 0.385 | 0.459 |
| 生成气体/ml | 280 | 336 | 336 |
(1)甲组实验中,盐酸
(2)该盐酸的物质的量浓度
(3)合金中Mg、Al的物质的量之比为
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为
 ,并使Mg2+刚好沉淀完全,则溶液中
,并使Mg2+刚好沉淀完全,则溶液中 的物质的量为
的物质的量为
您最近一年使用:0次
名校
6 . 五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)⇌PCl5(g)ΔH =-93.0kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0mol PCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:
(1)0~150 s内的平均反应速率υ(PCl3)=_______ mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)_______ 。
(3)反应至250 s时,该反应放出的热量为_______ kJ。
(4)下列关于上述反应的说法中,正确的是(填字母序号)_______ 。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
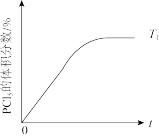
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线_______ 。
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率υ(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为(可用分数表示)
(3)反应至250 s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是(填字母序号)
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
(5)温度为T1时,混合气体中PCl5的体积分数随时间t变化的示意图如图。其他条件相同,请在图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
2021-03-23更新
|
194次组卷
|
2卷引用:安徽省六安市新安中学2020-2021学年高二下学期入学考试(普通班)化学试题
名校
7 . 化学科学家采用丙烯歧化法制取乙烯和丁烯的反应原理为2C3H6(g) C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:
(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
①a=_______ ,p初始:p5min=_______ 。
②其他条件不变,若缩小反应器的体积,则C3H6转化率_______ (填“增大”“减小”或“不变”)。
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:
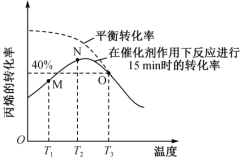
①N点_______ (填“有”或“没有”)达到平衡状态,原因是_______ 。
②M→N过程中C3H6转化率升高的原因是_______ 。
③T3时Kc=_______ ,若其他条件不变,往反应器中再加入2 mol C3H6,反应重新达到平衡时混合体系中乙烯的体积分数为_______ 。
 C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| C2H4的物质的量/mol | 0 | 0.8 | 1.2 | 1.5 | a | 1.5 |
①a=
②其他条件不变,若缩小反应器的体积,则C3H6转化率
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:

①N点
②M→N过程中C3H6转化率升高的原因是
③T3时Kc=
您最近一年使用:0次
2021-03-21更新
|
213次组卷
|
3卷引用:安徽省江淮名校2020-2021学年高二下学期开学联考化学试题
名校
解题方法
8 . 合成氨工业中,每生产2 mol NH3放出92.4 kJ热量。
(1)写出合成氨反应的热化学方程式为_______ 。
(2)已知:

1 mol N-H键断裂吸收的能量等于_______ kJ。
(3)已知关于铁的氧化物存在下列三个热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= -24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ/mol
则CO还原FeO的热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) △H=_______ kJ/mol。
(1)写出合成氨反应的热化学方程式为
(2)已知:

1 mol N-H键断裂吸收的能量等于
(3)已知关于铁的氧化物存在下列三个热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= -24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ/mol
则CO还原FeO的热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) △H=
您最近一年使用:0次
9 . 一种含钠的化合物W的组成可以表示为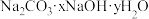 。为测定其组成,某学习小组做了如下实验:
。为测定其组成,某学习小组做了如下实验:
①称取27.6g化合物W,并配制成100mL 的物质的量浓度为
的物质的量浓度为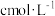 的溶液。
的溶液。
②取出10mL①中所得溶液,加入足量的 溶液,充分反应后,将得到的沉淀过滤、洗涤、干燥,称量得1.97g固体a。
溶液,充分反应后,将得到的沉淀过滤、洗涤、干燥,称量得1.97g固体a。
③另取出10mL①中所得溶液,加入1 的盐酸,充分反应至无气体放出,消耗盐酸的体积为40mL。
的盐酸,充分反应至无气体放出,消耗盐酸的体积为40mL。
(1)配制成100 mL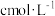 溶液时,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、
溶液时,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、_______ 。
(2)固体a为_______ (填化学式)。
(3)化合物W的组成中x=_______ ,y=_______ 。
(4)①中c=_______ 。
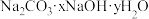 。为测定其组成,某学习小组做了如下实验:
。为测定其组成,某学习小组做了如下实验:①称取27.6g化合物W,并配制成100mL
 的物质的量浓度为
的物质的量浓度为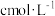 的溶液。
的溶液。②取出10mL①中所得溶液,加入足量的
 溶液,充分反应后,将得到的沉淀过滤、洗涤、干燥,称量得1.97g固体a。
溶液,充分反应后,将得到的沉淀过滤、洗涤、干燥,称量得1.97g固体a。③另取出10mL①中所得溶液,加入1
 的盐酸,充分反应至无气体放出,消耗盐酸的体积为40mL。
的盐酸,充分反应至无气体放出,消耗盐酸的体积为40mL。(1)配制成100 mL
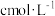 溶液时,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、
溶液时,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、(2)固体a为
(3)化合物W的组成中x=
(4)①中c=
您最近一年使用:0次
2021-02-02更新
|
134次组卷
|
2卷引用:安徽省皖南八校2020-2021学年高一下学期开学联考化学试题
12-13高三上·安徽滁州·阶段练习
名校
解题方法
10 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:安徽省六安中学2021届高三上学期开学考试化学试题
安徽省六安中学2021届高三上学期开学考试化学试题(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



