1 . 2022年1月,南太平洋岛国汤加境内发生了“21世纪至今最剧烈的火山喷发”,对该国造成了严重的破坏。火山喷发过程部分化学反应如下:
①
②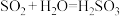
③
(1)在上述方程式涉及的物质中,能与盐酸反应的氧化物有_______ (填化学式),属于酸的有_______ (填化学式)。
(2) 与
与 具有某些相似的化学性质,写出用NaOH溶液吸收
具有某些相似的化学性质,写出用NaOH溶液吸收 的化学方程式:
的化学方程式:_______ 。
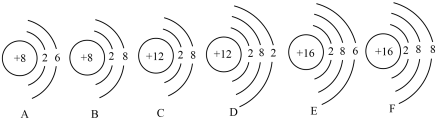
(3)下列粒子结构示意图中,表示S的是_______ (填字母),表示 的是
的是_______ (填字母)。
(4) 是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。
是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。
①一个 分子中含有
分子中含有_______ 个原子,其中H元素与S元素的质量比为_______ 。
②将 气体通入石蕊试液中,试液由紫色变为
气体通入石蕊试液中,试液由紫色变为_______ 色。
③ 称为正盐,
称为正盐, 称为酸式盐,写出
称为酸式盐,写出 的一种酸式盐的化学式:
的一种酸式盐的化学式:_______ 。
①

②
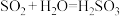
③

(1)在上述方程式涉及的物质中,能与盐酸反应的氧化物有
(2)
 与
与 具有某些相似的化学性质,写出用NaOH溶液吸收
具有某些相似的化学性质,写出用NaOH溶液吸收 的化学方程式:
的化学方程式:(3)下列粒子结构示意图中,表示S的是
 的是
的是
(4)
 是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。
是火山爆发过程中产生的酸性气体,属于二元弱酸,其饱和溶液的pH约为4。①一个
 分子中含有
分子中含有②将
 气体通入石蕊试液中,试液由紫色变为
气体通入石蕊试液中,试液由紫色变为③
 称为正盐,
称为正盐, 称为酸式盐,写出
称为酸式盐,写出 的一种酸式盐的化学式:
的一种酸式盐的化学式:
您最近一年使用:0次
名校
解题方法
2 . 我国正式公布实现碳达峰、碳中和的时间和目标后,使含碳化合物的综合利用更受关注和重视。回答下列问题:
(1)通过 插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):

下列说法正确的是_______(填选项字母)。
(2)二氧化碳与氢气重整体系中涉及的主要反应如下:
Ⅰ. ;
;
Ⅱ. 。
。
①二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为_______ ;恒温恒容密闭容器中进行该反应,下列事实能说明反应达到平衡状态的是_______ (填选项字母)。
A. 与
与 的有效碰撞几率不变
的有效碰撞几率不变
B.相同时间内形成C-H键和H-H键的数目相等
C.混合气体的密度不再改变
D.氢原子数不再改变
②一定温度下,向10L恒容密闭容器中充入 和
和 ,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得
,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得 的转化率为50%,
的转化率为50%, 与CO的分压之比为1∶4,
与CO的分压之比为1∶4, 的分压为p0。则
的分压为p0。则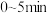 内,平均反应速率
内,平均反应速率
_______  ;反应Ⅱ的平衡常数Kp=
;反应Ⅱ的平衡常数Kp=_______ (Kp是用分压表示的平衡常数)。
③向恒容密闭容器中以物质的量之比为1∶4充入 和
和 ,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示
,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为_______ (填“L1”“L2”或“L3”);T1℃之后, 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为_______ ;T1℃时CO的平衡分压_______ (填“>”“<”或“=”) T2℃时CO的平衡分压,理由为_______ 。

(1)通过
 插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
下列说法正确的是_______(填选项字母)。
| A.水分子对插入反应有促进作用 |
| B.稳定性:TS>TS′ |
| C.无水体系中反应的活化能为127.9kJ/mol |
| D.两个体系中均存在极性键的断裂和形成 |
Ⅰ.
 ;
;Ⅱ.
 。
。①二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为
A.
 与
与 的有效碰撞几率不变
的有效碰撞几率不变B.相同时间内形成C-H键和H-H键的数目相等
C.混合气体的密度不再改变
D.氢原子数不再改变
②一定温度下,向10L恒容密闭容器中充入
 和
和 ,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得
,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得 的转化率为50%,
的转化率为50%, 与CO的分压之比为1∶4,
与CO的分压之比为1∶4, 的分压为p0。则
的分压为p0。则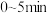 内,平均反应速率
内,平均反应速率
 ;反应Ⅱ的平衡常数Kp=
;反应Ⅱ的平衡常数Kp=③向恒容密闭容器中以物质的量之比为1∶4充入
 和
和 ,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示
,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为
您最近一年使用:0次
名校
3 . 甲醇是重要的化工原料,在生产生活中应用广泛,碳氧化物与氢气在一定条件下可合成甲醇。回答下列问题:
Ⅰ.一氧化碳与氢气合成甲醇的反应为CO(g)+2H2(g) CH3OH(g)。在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂作用下发生上述反应,测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂作用下发生上述反应,测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:

(1)该反应的正反应为____ 反应(填“放热”或“吸热”)。
(2)容器的容积①____ ③(填“>”“<”或“=”)。
(3)P点时,H2的转化率为____ ;若其他条件不变,将恒容密闭容器改为恒压密闭容器,平衡后H2的转化率将____ (填“增大”“减小”或“不变”)。
Ⅱ.二氧化碳与氢气合成甲醇的主要反应如下:
反应①:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-58kJ/mol
CH3OH(g)+H2O(g) △H1=-58kJ/mol
反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ/mol
CO(g)+H2O(g) △H2=+41kJ/mol
(4)反应时温度控制在230~280℃之间,温度不能过高的原因是___ 。
(5)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2(g)和H2(g)发生上述反应。达到平衡时CO2的转化率为20%,CH3OH的选择性为75%[CH3OH的选择性= ×100%],则反应②的平衡常数Kp=
×100%],则反应②的平衡常数Kp=____ 。(Kp为以分压表示的平衡常数)
(6)酸性CH3OH燃料电池具有低温快速启动、燃料洁净环保、电池结构简单等特性,其放电时负极的电极反应式为____ 。
Ⅰ.一氧化碳与氢气合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g)。在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂作用下发生上述反应,测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂作用下发生上述反应,测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
(1)该反应的正反应为
(2)容器的容积①
(3)P点时,H2的转化率为
Ⅱ.二氧化碳与氢气合成甲醇的主要反应如下:
反应①:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-58kJ/mol
CH3OH(g)+H2O(g) △H1=-58kJ/mol反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ/mol
CO(g)+H2O(g) △H2=+41kJ/mol(4)反应时温度控制在230~280℃之间,温度不能过高的原因是
(5)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2(g)和H2(g)发生上述反应。达到平衡时CO2的转化率为20%,CH3OH的选择性为75%[CH3OH的选择性=
 ×100%],则反应②的平衡常数Kp=
×100%],则反应②的平衡常数Kp=(6)酸性CH3OH燃料电池具有低温快速启动、燃料洁净环保、电池结构简单等特性,其放电时负极的电极反应式为
您最近一年使用:0次
2022-03-07更新
|
487次组卷
|
3卷引用:2022年广东卷高考真题变式题(17-21)
(已下线)2022年广东卷高考真题变式题(17-21)云南省昆明市第一中学西山学校2022届高三适应性月考(六)化学试题江西省宜春市上高二中2021-2022学年高二下学期第四次月考试题(3月)化学试题
4 . 氢气既是重要的化工原料,又属于洁净能源,是未来人类重点开发的能源之一,请回答下列问题:
(1)氢气可以与煤在催化剂作用下制备乙炔,其总反应式为: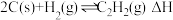 。已知部分反应如下:
。已知部分反应如下:
Ⅰ. ;
;
Ⅱ. ;
;
Ⅲ.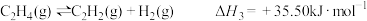 ;
;
①
___________ ;说明反应Ⅱ在高温下可自发进行的原因为___________ 。
②一定条件下,向 的恒容密闭容器中加入足量碳粉和
的恒容密闭容器中加入足量碳粉和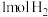 ,发生上述反应Ⅰ、Ⅱ、Ⅲ,
,发生上述反应Ⅰ、Ⅱ、Ⅲ, 后容器内总压强不再变化,容器中
后容器内总压强不再变化,容器中 为
为 ,
, 为
为 ,
, 为
为 ,
, 内
内 的平均反应速率
的平均反应速率
___________ ,反应Ⅰ的平衡常数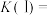
___________ (写出计算式)。
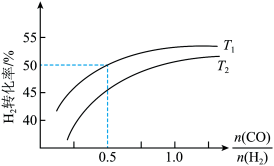
(2)氢气可以用于合成甲醇的反应为 ,在恒压条件下测得
,在恒压条件下测得 的平衡转化率与温度和投料比关系如图所示:
的平衡转化率与温度和投料比关系如图所示:
①已知 ,则
,则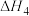
___________ (填“>”“<”或“=”)0。
②由图可知,同温同压下 越大,
越大, 的平衡转化率越大,原因为
的平衡转化率越大,原因为___________ 。
③写出一条可同时提高反应速率和 平衡转化率的措施:
平衡转化率的措施:___________ 。
④保证该压强不变,向 温度下,
温度下,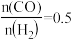 的平衡体系中再加入
的平衡体系中再加入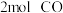 、
、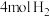 、
、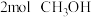 ,则化学平衡
,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)氢气可以与煤在催化剂作用下制备乙炔,其总反应式为:
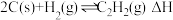 。已知部分反应如下:
。已知部分反应如下:Ⅰ.
 ;
;Ⅱ.
 ;
;Ⅲ.
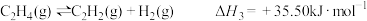 ;
;①

②一定条件下,向
 的恒容密闭容器中加入足量碳粉和
的恒容密闭容器中加入足量碳粉和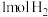 ,发生上述反应Ⅰ、Ⅱ、Ⅲ,
,发生上述反应Ⅰ、Ⅱ、Ⅲ, 后容器内总压强不再变化,容器中
后容器内总压强不再变化,容器中 为
为 ,
, 为
为 ,
, 为
为 ,
, 内
内 的平均反应速率
的平均反应速率
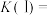
(2)氢气可以用于合成甲醇的反应为
 ,在恒压条件下测得
,在恒压条件下测得 的平衡转化率与温度和投料比关系如图所示:
的平衡转化率与温度和投料比关系如图所示:
①已知
 ,则
,则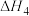
②由图可知,同温同压下
 越大,
越大, 的平衡转化率越大,原因为
的平衡转化率越大,原因为③写出一条可同时提高反应速率和
 平衡转化率的措施:
平衡转化率的措施:④保证该压强不变,向
 温度下,
温度下,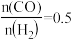 的平衡体系中再加入
的平衡体系中再加入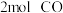 、
、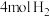 、
、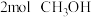 ,则化学平衡
,则化学平衡
您最近一年使用:0次
5 . I.温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

在合成CH3COOH的反应历程中,下列有关说法正确的是___________ (填字母)。
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键断裂和C—C键形成
c.生成乙酸的反应原子利用率100%
d.ΔH=E2-E1
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,温度对催化剂K-Fe-Mn/Si-2性能的影响如图2所示:工业生产中主反应应选择的温度是
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,温度对催化剂K-Fe-Mn/Si-2性能的影响如图2所示:工业生产中主反应应选择的温度是___________ 。

(3)在一定温度下的密闭容器中充入一定量的CO2和C2H6,发生主反应CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,固定时间测定不同压强下C2H4的产率如图3所示,P1压强下a点反应速率v(正)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,固定时间测定不同压强下C2H4的产率如图3所示,P1压强下a点反应速率v(正)___________ v(逆)。
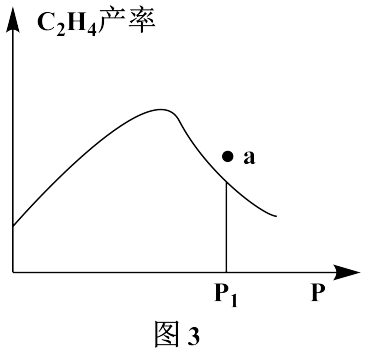
(4)某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,只发生主反应:
CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H6(g) CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去NO的反应原理如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH=−1980kJ/mol
5N2(g)+6H2O(g) ΔH=−1980kJ/mol
(5)反应速率与浓度之间存在如下关系:v正=k正c4(NH3)·c6(NO),v逆=k逆c5(N2)·c6(H2O)。k正、k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9molNH3(g)和1.2molNO(g)发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下 =
=___________ ;当温度升高时,k正增大m倍,k逆增大n倍,则m___________ n(填“>”、“<”或“=”)。
(6)初始投料量一定,平衡时NO的转化率与温度、压强的关系如图2所示,则P1、P2、P3由大到小的顺序为___________ ,原因是___________ 。

(7)保持温度不变,在恒容密闭容器中按一定比充入NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数φ(H2O)随 的变化如图3所示,当
的变化如图3所示,当 时,达到平衡时φ(H2O)可能是A、B、C三点中的
时,达到平衡时φ(H2O)可能是A、B、C三点中的___________ (填“A”、“B”或“C”)。
(1)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

在合成CH3COOH的反应历程中,下列有关说法正确的是
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键断裂和C—C键形成
c.生成乙酸的反应原子利用率100%
d.ΔH=E2-E1
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,温度对催化剂K-Fe-Mn/Si-2性能的影响如图2所示:工业生产中主反应应选择的温度是
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,温度对催化剂K-Fe-Mn/Si-2性能的影响如图2所示:工业生产中主反应应选择的温度是
(3)在一定温度下的密闭容器中充入一定量的CO2和C2H6,发生主反应CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,固定时间测定不同压强下C2H4的产率如图3所示,P1压强下a点反应速率v(正)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1,固定时间测定不同压强下C2H4的产率如图3所示,P1压强下a点反应速率v(正)
(4)某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6,只发生主反应:
CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)C2H6(g)
 CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=
II.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去NO的反应原理如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH=−1980kJ/mol
5N2(g)+6H2O(g) ΔH=−1980kJ/mol(5)反应速率与浓度之间存在如下关系:v正=k正c4(NH3)·c6(NO),v逆=k逆c5(N2)·c6(H2O)。k正、k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9molNH3(g)和1.2molNO(g)发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
 =
=(6)初始投料量一定,平衡时NO的转化率与温度、压强的关系如图2所示,则P1、P2、P3由大到小的顺序为

(7)保持温度不变,在恒容密闭容器中按一定比充入NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数φ(H2O)随
 的变化如图3所示,当
的变化如图3所示,当 时,达到平衡时φ(H2O)可能是A、B、C三点中的
时,达到平衡时φ(H2O)可能是A、B、C三点中的
您最近一年使用:0次
名校
解题方法
6 . 甲醇是一种重要的有机化工原料,在工业上有着重要的用途。
(1)利用CO和H,也可以合成甲醇,其反应为
 ,相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1∶2的CO和
,相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1∶2的CO和 的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。
的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。
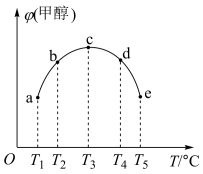
①从a点到c点,温度升高甲醇的体积分数增大的原因是___________ 。
②根据图象判断a___________ (填“>”“<”或“=”)0。
③下列说法能说明反应达到平衡状态的是___________ (填字母)。
A.容器中气体压强不再变化
B.用 和
和 表示的反应速率之比为2∶1
表示的反应速率之比为2∶1
C.混合气体的密度不变
D.单位时间内生成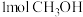 的同时生成
的同时生成
(2)若在 、10MPa条件下,往一密闭容器通入CO和
、10MPa条件下,往一密闭容器通入CO和 合成甲醇[其中
合成甲醇[其中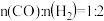 ],测得容器内总压强与反应时间的关系如图所示。
],测得容器内总压强与反应时间的关系如图所示。

①图中A点时,CO的转化率为___________ 。
②在其他条件不变的情况下,测得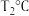 时压强的变化曲线如图所示,则C点的正反应速率
时压强的变化曲线如图所示,则C点的正反应速率 与A点的逆反应速率
与A点的逆反应速率 的大小关系为
的大小关系为
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③图中B点的压强平衡常数
___________ ( 为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
(1)利用CO和H,也可以合成甲醇,其反应为

 ,相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1∶2的CO和
,相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1∶2的CO和 的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。
的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图所示。
①从a点到c点,温度升高甲醇的体积分数增大的原因是
②根据图象判断a
③下列说法能说明反应达到平衡状态的是
A.容器中气体压强不再变化
B.用
 和
和 表示的反应速率之比为2∶1
表示的反应速率之比为2∶1C.混合气体的密度不变
D.单位时间内生成
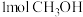 的同时生成
的同时生成
(2)若在
 、10MPa条件下,往一密闭容器通入CO和
、10MPa条件下,往一密闭容器通入CO和 合成甲醇[其中
合成甲醇[其中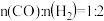 ],测得容器内总压强与反应时间的关系如图所示。
],测得容器内总压强与反应时间的关系如图所示。
①图中A点时,CO的转化率为
②在其他条件不变的情况下,测得
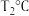 时压强的变化曲线如图所示,则C点的正反应速率
时压强的变化曲线如图所示,则C点的正反应速率 与A点的逆反应速率
与A点的逆反应速率 的大小关系为
的大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③图中B点的压强平衡常数

 为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
您最近一年使用:0次
2021-11-21更新
|
1013次组卷
|
6卷引用:2022年广东卷高考真题变式题(17-21)
(已下线)2022年广东卷高考真题变式题(17-21)湖南师范大学附属中学2021-2022学年高三上学期月考试卷(二)化学试题江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题安徽省宣城中学2021-2022学年高二上学期12月月考化学试题(已下线)模拟卷06-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题
名校
7 . 酸碱混合时可以得到滴定图像、物种分布图像等。
(1)室温下,用未知浓度NaOH溶液分别滴定20.00 mL物质的量浓度相同的盐酸和醋酸,所得溶液的pH随NaOH溶液体积的变化如下图所示。

①在滴定的某时刻,滴定管中液面如图所示,此时滴定管读数为______ mL。

②A点时溶液中c(Na+)、c(CH3COOH)、c(CH3COO-)由大到小的顺序为______ 。
③B点时溶液中由水电离出的c(H+)=______ mol·L-1。若忽略混合时溶液体积的变化,B点时所滴加NaOH溶液的体积为______ mL。(结果保留1位小数)
(3)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的分布系数δ随pH变化的关系如图所示。

①若以酚酞为指示剂,当溶液由无色变为浅红色时主要反应的离子方程式为______ 。
②25℃,pH=3时溶液中 =
=______ 。
(1)室温下,用未知浓度NaOH溶液分别滴定20.00 mL物质的量浓度相同的盐酸和醋酸,所得溶液的pH随NaOH溶液体积的变化如下图所示。

①在滴定的某时刻,滴定管中液面如图所示,此时滴定管读数为

②A点时溶液中c(Na+)、c(CH3COOH)、c(CH3COO-)由大到小的顺序为
③B点时溶液中由水电离出的c(H+)=
(3)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的分布系数δ随pH变化的关系如图所示。

①若以酚酞为指示剂,当溶液由无色变为浅红色时主要反应的离子方程式为
②25℃,pH=3时溶液中
 =
=
您最近一年使用:0次
2020-12-23更新
|
547次组卷
|
4卷引用:2022年广东卷高考真题变式题(17-21)
(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练江苏省南通市如皋中学2020-2021学年高三上学期教学质量调研(二)化学试题江苏省徐州市王杰中学2022-2023学年高三上学期10月阶段检测化学试题
解题方法
8 . 丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g)  C3H6(g)+H2(g)。请回答下列相关问题。
C3H6(g)+H2(g)。请回答下列相关问题。
(1)一定温度下,向2 L的密闭容器中充入2 mol C3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率υ(H2)=_________ ,C3H8的平衡转化率为_________ 。
②下列情况能说明该反应达到平衡状态的是___________ 。
A.混合气体的平均分子量保持不变
B.C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D.C3H8的分解速率与C3H6的消耗速率相等
(2)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
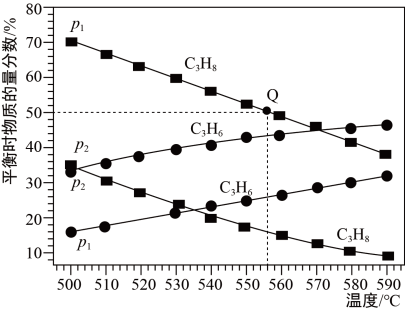
①压强:p1______ p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是_________ 。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是_________ 。
 C3H6(g)+H2(g)。请回答下列相关问题。
C3H6(g)+H2(g)。请回答下列相关问题。(1)一定温度下,向2 L的密闭容器中充入2 mol C3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率υ(H2)=
②下列情况能说明该反应达到平衡状态的是
A.混合气体的平均分子量保持不变
B.C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D.C3H8的分解速率与C3H6的消耗速率相等
(2)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp=
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是
您最近一年使用:0次
名校
9 . 按要求回答下列问题:
(1)按要求书写下列反应方程式
①泡沫灭火器工作原理的离子方程式为___________________ 。
②SbOCl水解生成Sb2O3的化学方程式为____________________ 。
③CH3MgCl是一种重要的有机合成试剂,该化合物水解的化学方程式为____________________ 。
(2)取V1 mL0.01mol/L的NaOH溶液与V2 mL同浓度的H2SO4溶液充分混合,所得溶液的pH=2,则V1:V2=____________ (混合过程中体积变化忽略不计)。
(3)硫酸肼(N2H6SO4)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
①写出硫酸肼第一步水解反应的离子方程式:___________________ 。
②硫酸肼水溶液中离子浓度的排列顺序正确的是__________ (填字母)。
A.c( )>c(
)>c(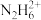 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c( )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(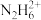 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(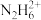 )>c(
)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(4)常温下,将a mol/L的CH3COONa溶液和b mol/L的盐酸等体积混合后,溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=__________ 。
(5)若0.1 mol/L的H2B溶液在常温下的pH=3,c(B2-)=1×10-6 mol/L,则Na2B的Kh=________ 。
(1)按要求书写下列反应方程式
①泡沫灭火器工作原理的离子方程式为
②SbOCl水解生成Sb2O3的化学方程式为
③CH3MgCl是一种重要的有机合成试剂,该化合物水解的化学方程式为
(2)取V1 mL0.01mol/L的NaOH溶液与V2 mL同浓度的H2SO4溶液充分混合,所得溶液的pH=2,则V1:V2=
(3)硫酸肼(N2H6SO4)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
①写出硫酸肼第一步水解反应的离子方程式:
②硫酸肼水溶液中离子浓度的排列顺序正确的是
A.c(
 )>c(
)>c(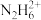 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)B.c(
 )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)C.2c(
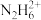 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)D.c(
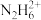 )>c(
)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)(4)常温下,将a mol/L的CH3COONa溶液和b mol/L的盐酸等体积混合后,溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=
(5)若0.1 mol/L的H2B溶液在常温下的pH=3,c(B2-)=1×10-6 mol/L,则Na2B的Kh=
您最近一年使用:0次
名校
10 . 填表:
| 实验操作 | 实验现象 | 离子反应方程式 |
| 一小块钠投入滴有酚酞的水中 | ||
| 碳酸钠与醋酸溶液混合 | ||
| 盐酸加入KHCO3溶液中 | ||
| 澄清石灰水加入NaHCO3溶液中 |
您最近一年使用:0次



