I.请用下列10种物质的序号填空。
①N2 ②NH4Cl ③RbOH ④ ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气
(1)既含离子键又含共价键的是___________ ;只含共价键的的是___________ ;④的电子式为___________ ;⑦的空间构型为:___________ 。
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑭回答下列问题。
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:___________ (填元素符号)。
ii.能作为卤素非金属性递变规律的判断依据的是:___________ 。
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因___________ 。
(3)下列关于②~⑤元素叙述正确的是___________。
(4)③⑧⑩元素最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性”的离子方程式分别为___________ 、___________ 。
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是___________ (用化学式表示)。
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为___________ (用相应的离子符号排序)。
(7)用电子式表示①和⑦形成化合物的过程___________ ,该化合物与水反应的化学方程式是___________ 。
①N2 ②NH4Cl ③RbOH ④
 ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气(1)既含离子键又含共价键的是
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
| 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ⑨ | ⑪ | |||||
| 3 | ③ | ⑥ | ⑧ | ⑩ | ⑫ | |||
| 4 | ④ | ⑦ | ⑬ | |||||
| 5 | ⑤ | ⑭ |
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:
ii.能作为卤素非金属性递变规律的判断依据的是:
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因
(3)下列关于②~⑤元素叙述正确的是___________。
| A.从上到下②~⑤单质与水反应越来越剧烈 |
| B.②~⑤单质与氧气反应均可生成过氧化物 |
| C.从上到下②~⑤单质熔沸点逐渐升高 |
| D.②~⑤元素的最高价氧化物的水化物碱性增强 |
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为
(7)用电子式表示①和⑦形成化合物的过程
更新时间:2024-05-07 13:16:36
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】短周期元素X、Y、Z在周期表中的位置关系如图所示,据此回答下列问题:
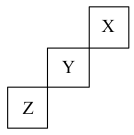
(1)X元素形成单质的分子式是_________________ 。
(2)写出Y元素在周期表中的位置_____________________ ,其原子结构示意图为_________________________ 。
(3)写出单质Z与钠反应的化学方程式:_______________________________ 。

(1)X元素形成单质的分子式是
(2)写出Y元素在周期表中的位置
(3)写出单质Z与钠反应的化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】如表是元素周期表的一部分,按要求填空(填元素符号或化学式)
(1)①元素的元素名称____________ ;⑩元素的元素符号_________________ 。
(2)在这些元素中,____________ 是最活泼的金属元素;_____________ 是最活泼的非金属元素;________ 是最不活泼的元素(用元素符号填写)。
(3)能形成气态氢化物.,且气态氢化物最稳定的是___________ (用化学式填写)。
(4)这些元素的最高价氧化物对应水化物中的最强酸是_________ ;最强的碱是_________ ;具有两性的氢氧化物是________ (用化学式填写)。
(5)从⑤到⑪的元素中,____________ 原子半径最小(用元素符号填写)。
(6)比较⑤与⑥的化学性质,_________ 更活泼(用元素符号填写),试用实验证明此现象(简述实验操作、现象和结论)________________ 。
(7)用电子式表示④与⑥所组成物质的形成过程_______________ ,该化合物属于___________ (填“共价”或“离子”)化合物。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)①元素的元素名称
(2)在这些元素中,
(3)能形成气态氢化物.,且气态氢化物最稳定的是
(4)这些元素的最高价氧化物对应水化物中的最强酸是
(5)从⑤到⑪的元素中,
(6)比较⑤与⑥的化学性质,
(7)用电子式表示④与⑥所组成物质的形成过程
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是______ 。
(2)金属镁可以用来生产金属铀(元素符号是U): ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是______ (填化学式,下同),被还原的物质是______ 。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
由实验1和实验2得出的结论是:金属性,______ >______ >______ (填元素符号),用原子结构理论解释:同周期元素从左到右,______ 。
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式______ 。
(1)Al在元素周期表中的位置是
(2)金属镁可以用来生产金属铀(元素符号是U):
 ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
| 实验1 | 实验2 |
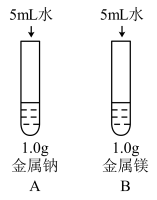 |  |
| 钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性,
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】回答下列问题:
(1)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是_______ (填字母,下同)。
a.比较这两种元素的单质的硬度和熔点
b.Mg(OH)2属于中强碱,Al(OH)3属于两性氢氧化物
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(2)某同学认为铝有一定的非金属性,下列化学反应中,你认为能支持该同学观点的是_______ 。
a.铝片与盐酸反应放出氢气
b.氢氧化铝溶于强碱溶液
c.氢氧化铝溶于强酸溶液
(1)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是
a.比较这两种元素的单质的硬度和熔点
b.Mg(OH)2属于中强碱,Al(OH)3属于两性氢氧化物
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(2)某同学认为铝有一定的非金属性,下列化学反应中,你认为能支持该同学观点的是
a.铝片与盐酸反应放出氢气
b.氢氧化铝溶于强碱溶液
c.氢氧化铝溶于强酸溶液
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】V、W、X、Y、Z为五种短周期主族元素,它们的原子序数依次增大,其中只有X元素为金属元素。V和X元素原子的最外层电子数相等,Y的最高正价与最低负价的代数和为4,X、Y元素的质子数之和是V、W元素原质子数之和的3倍,Z元素的单质是黄绿色气体,其水溶液能使有色布条褪色。请回答下列问题:
(1)请写出元素符号:V为___________ ,X为___________ W为___________ ,Y为___________ ,Z为___________ 。
(2)Y元素形成的简单离子的结构示意图为___________ 。
(3)V、W、X三种元素形成的简单离子的半径从大到小的顺序为___________ (用离子符号表示)。
(4)由V、W、X三种元素组成的物质为___________ (填化学式),其与 反应的化学方程式为
反应的化学方程式为___________ 。
(5)非金属性:Y___________ Z(填“>”或“<”),请举出一个能说明这一事实的依据:___________ 。
(1)请写出元素符号:V为
(2)Y元素形成的简单离子的结构示意图为
(3)V、W、X三种元素形成的简单离子的半径从大到小的顺序为
(4)由V、W、X三种元素组成的物质为
 反应的化学方程式为
反应的化学方程式为(5)非金属性:Y
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】下表列出了 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:

(1)f的名称是_______ ,d的元素符号是_______ ;
(2)a在周期表中的位置是_______ ;
(3)h的原子结构示意图是_______ ;
(4)e、g、i按原子半径由大到小的顺序排列为_______ (填元素符号);
(5)c与h相比非金属性较强的是_______ (填元素符号),h的氢化物与i的氢化物相比,稳定性较弱的是_______ (填化学式);
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为_______ ;
(7)g的单质与氧化铁在高温条件下反应的化学方程式为_______ ;
(8)i的氢化物的电子式为_______ 。
 九种元素在周期表中的位置,根据要求回答下列问题:
九种元素在周期表中的位置,根据要求回答下列问题:
(1)f的名称是
(2)a在周期表中的位置是
(3)h的原子结构示意图是
(4)e、g、i按原子半径由大到小的顺序排列为
(5)c与h相比非金属性较强的是
(6)e的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物,在水溶液中反应的离子方程式为
(7)g的单质与氧化铁在高温条件下反应的化学方程式为
(8)i的氢化物的电子式为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】下表为元素周期表的一部分。
回答下列问题:
(1)X元素位于周期表的第_______ 周期。
(2)H2S的稳定性_______ (填“>”或“<”)HZ。
(3)W元素原子的得电子能力弱于Y的原因是_______ (请用元素符号作答)。
(4)Se是动植物体营养元素,位于周期表第四周期,与硫同主族。下列关于Se的推断中,正确的是:_______ 。
a.原子半径:Se>S
b.Se最高价氧化物对应的水化物的酸性强于H2SO4
c.SeO2只具有氧化性
| 碳 | W | Y | |
| X | 硫 | Z |
回答下列问题:
(1)X元素位于周期表的第
(2)H2S的稳定性
(3)W元素原子的得电子能力弱于Y的原因是
(4)Se是动植物体营养元素,位于周期表第四周期,与硫同主族。下列关于Se的推断中,正确的是:
a.原子半径:Se>S
b.Se最高价氧化物对应的水化物的酸性强于H2SO4
c.SeO2只具有氧化性
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】黑火药是中国四大发明之一,其爆炸反应的化学方程式是:2KNO3 + 3C + S→A + N2↑ + 3CO2↑,完成下列填空:
(1)化学方程式中的第二周期元素非金属性由强到弱的顺序依次为_____________________ 。
(2)N2的电子式为_____________ 。
(3)生成物A的化学式为________ ;其晶体类型为_________ ;构成晶体A的微粒半径大小关系为________ (用微粒符号表示)。
(4)说明氮元素的非金属性比碳元素强的事实是___________ 。
(1)化学方程式中的第二周期元素非金属性由强到弱的顺序依次为
(2)N2的电子式为
(3)生成物A的化学式为
(4)说明氮元素的非金属性比碳元素强的事实是
您最近一年使用:0次



