已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中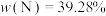 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
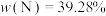 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
更新时间:2023-06-22 15:40:52
|
【知识点】 元素周期表结构
相似题推荐
填空题
|
较难
(0.4)
【推荐1】镁、钡是位于同一主族的活泼的金属元素。
回答下列问题:
(1)镁在元素周期表中的位置是:______________ ;钡位于周期表第六周期,钡原子最外层电子的电子排布式是:________ 。
(2)铝也是一种活泼金属,铝的金属性比钡的_____ (填“强”或“弱”)。工业上可用如下方法制取钡:2Al+4BaO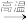 3Ba↑+BaO·Al2O3,该法制钡的主要原因是
3Ba↑+BaO·Al2O3,该法制钡的主要原因是______ (选填选项)
a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:___________ 。
(4)写出b点溶液中大量存在的阴离子的电子式:_________ 。
(5)a、b、c、d点溶液呈中性的是____________________ 。
回答下列问题:
(1)镁在元素周期表中的位置是:
(2)铝也是一种活泼金属,铝的金属性比钡的
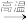 3Ba↑+BaO·Al2O3,该法制钡的主要原因是
3Ba↑+BaO·Al2O3,该法制钡的主要原因是a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
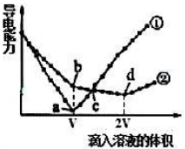
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:
(4)写出b点溶液中大量存在的阴离子的电子式:
(5)a、b、c、d点溶液呈中性的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】 是一种锂离子电池的正极材料。用
是一种锂离子电池的正极材料。用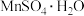 在一定条件下可制得
在一定条件下可制得 。回答下列问题:
。回答下列问题:
(1)写出 在周期表中的位置
在周期表中的位置___________ 。
(2)将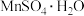 进行热分解,在
进行热分解,在 时,固体残留率为
时,固体残留率为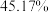 ,写出残留固体(
,写出残留固体( )的化学式
)的化学式___________ (已知:固体残留率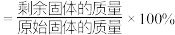 )。
)。
(3)将固体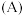 与
与 混合并在空气中煅烧,反应生成
混合并在空气中煅烧,反应生成 ,写出该反应中氧化剂与还原剂物质的之比
,写出该反应中氧化剂与还原剂物质的之比___________ 。
(4)该正极材料充电一段时间后变为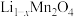 ,为测定
,为测定 的值。称取
的值。称取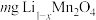 固体,经一系列化学处理,将锂全部转化为
固体,经一系列化学处理,将锂全部转化为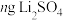 ,写出
,写出 的表达式
的表达式___________ 。
 是一种锂离子电池的正极材料。用
是一种锂离子电池的正极材料。用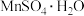 在一定条件下可制得
在一定条件下可制得 。回答下列问题:
。回答下列问题:(1)写出
 在周期表中的位置
在周期表中的位置(2)将
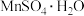 进行热分解,在
进行热分解,在 时,固体残留率为
时,固体残留率为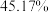 ,写出残留固体(
,写出残留固体( )的化学式
)的化学式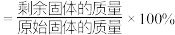 )。
)。(3)将固体
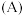 与
与 混合并在空气中煅烧,反应生成
混合并在空气中煅烧,反应生成 ,写出该反应中氧化剂与还原剂物质的之比
,写出该反应中氧化剂与还原剂物质的之比(4)该正极材料充电一段时间后变为
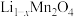 ,为测定
,为测定 的值。称取
的值。称取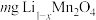 固体,经一系列化学处理,将锂全部转化为
固体,经一系列化学处理,将锂全部转化为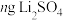 ,写出
,写出 的表达式
的表达式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
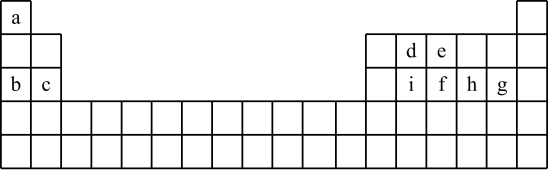
(1)a~i元素中,金属性最强的是________ ,最高价氧化物对应水化物中,酸性最强的物质是___________ 。g所在族的元素形成的氢化物中沸点最低的是____________________ 。
(2)比较b、e、g简单离子半径的大小___________________ (用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________ 、___________________ 。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________ 。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______ (填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________ ;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________ 。
(6)c与a形成的化合物的电子式为___________ ,用电子式表示a与h形成a2h的过程__________________________________________ 。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________ 。

(1)a~i元素中,金属性最强的是
(2)比较b、e、g简单离子半径的大小
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式
(4)用一个化学反应方程式表示d的非金属性强于i
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号
(6)c与a形成的化合物的电子式为
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式
您最近一年使用:0次



