1 . 我国科学家最近合成多孔壳核催化剂实现 氢化制备
氢化制备 。使用不同催化剂,
。使用不同催化剂, 的还原产物不同。
的还原产物不同。
反应1:
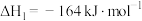
反应2:
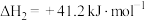
(1)一定温度下,在某刚性恒容密闭容器中充入1mol (g)和5mol
(g)和5mol  (g)仅发生上述反应1和反应2,达到平衡时测得CO为0.2mol,
(g)仅发生上述反应1和反应2,达到平衡时测得CO为0.2mol, (g)为1mol。
(g)为1mol。
①下列说法正确的是_______ (填字母)。
A.气体平均摩尔质量不随时间变化时达到平衡状态
B.平衡时 体积分数大于25%
体积分数大于25%
C.加入高效催化剂,降低反应活化能,缩短达到平衡的时间
D.平衡后充入稀有气体, 的平衡转化率增大
的平衡转化率增大
②体系中_______ (填“吸收”或“放出”)热量_______ kJ。
(2)在投料比和压强不变时,测得各物质平衡转化率与温度关系如图1所示;在投料比一定,测得平衡转化率与压强、温度关系如图2所示。
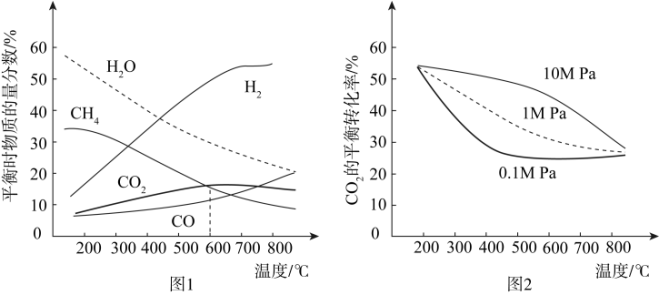
①200~600℃时, 的物质的量分数随温度升高而增大的主要原因是
的物质的量分数随温度升高而增大的主要原因是____ 。
②温度一定时,随着压强增大, 的平衡转化率增大,其主要原因是
的平衡转化率增大,其主要原因是___ 。
(3)在一定温度下,向恒容密闭容器充入1mol 和2mol
和2mol  发生反应:
发生反应: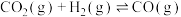
 ,经过10min达到平衡时体系的压强为原来压强60kPa的
,经过10min达到平衡时体系的压强为原来压强60kPa的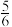 倍。该温度下,反应平衡常数
倍。该温度下,反应平衡常数 ,为
,为_____ 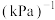 。反应开始到恰好平衡时
。反应开始到恰好平衡时 分压变化速率为
分压变化速率为__  。(已知:平衡分压代替平衡浓度计算。分压等于总压×物质的量分数)。
。(已知:平衡分压代替平衡浓度计算。分压等于总压×物质的量分数)。
 氢化制备
氢化制备 。使用不同催化剂,
。使用不同催化剂, 的还原产物不同。
的还原产物不同。反应1:

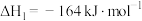
反应2:

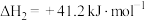
(1)一定温度下,在某刚性恒容密闭容器中充入1mol
 (g)和5mol
(g)和5mol  (g)仅发生上述反应1和反应2,达到平衡时测得CO为0.2mol,
(g)仅发生上述反应1和反应2,达到平衡时测得CO为0.2mol, (g)为1mol。
(g)为1mol。①下列说法正确的是
A.气体平均摩尔质量不随时间变化时达到平衡状态
B.平衡时
 体积分数大于25%
体积分数大于25%C.加入高效催化剂,降低反应活化能,缩短达到平衡的时间
D.平衡后充入稀有气体,
 的平衡转化率增大
的平衡转化率增大②体系中
(2)在投料比和压强不变时,测得各物质平衡转化率与温度关系如图1所示;在投料比一定,测得平衡转化率与压强、温度关系如图2所示。

①200~600℃时,
 的物质的量分数随温度升高而增大的主要原因是
的物质的量分数随温度升高而增大的主要原因是②温度一定时,随着压强增大,
 的平衡转化率增大,其主要原因是
的平衡转化率增大,其主要原因是(3)在一定温度下,向恒容密闭容器充入1mol
 和2mol
和2mol  发生反应:
发生反应: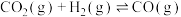
 ,经过10min达到平衡时体系的压强为原来压强60kPa的
,经过10min达到平衡时体系的压强为原来压强60kPa的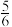 倍。该温度下,反应平衡常数
倍。该温度下,反应平衡常数 ,为
,为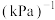 。反应开始到恰好平衡时
。反应开始到恰好平衡时 分压变化速率为
分压变化速率为 。(已知:平衡分压代替平衡浓度计算。分压等于总压×物质的量分数)。
。(已知:平衡分压代替平衡浓度计算。分压等于总压×物质的量分数)。
您最近一年使用:0次
2022-12-11更新
|
374次组卷
|
2卷引用:河南省TOP20名校2022-2023学年高三上学期12月调研考试化学试题
2 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
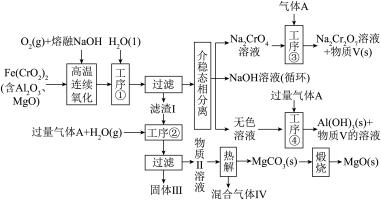
回答下列问题:
(1)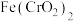 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:_________ 。
(2)滤渣Ⅰ的主要成分是_________ (填化学式)。工序③中发生反应的离子方程式为_________ 。
(3)热解工序产生的混合气体Ⅳ最适宜返回工序_________ (填“①”或“②”或“③”或“④”)参与内循环。
(4) 难溶于水,常温时
难溶于水,常温时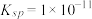 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。
①欲使 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为_________  的
的 溶液。
溶液。
②20℃时,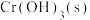 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确_________ 的是(填字母)。
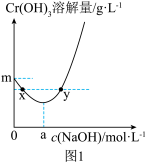
A.NaOH浓度越小,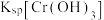 越小
越小
B.x、y两点对应的溶液中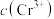 不相等
不相等
C.当NaOH浓度小于 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.当NaOH浓度为 时,溶液中
时,溶液中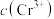 一定最小
一定最小
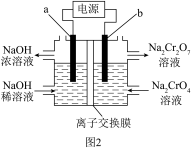
(5)工序③也可以利用电解法制 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为_________ (填离子符号)交换膜。制备 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少_________ g。
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
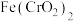 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:(2)滤渣Ⅰ的主要成分是
(3)热解工序产生的混合气体Ⅳ最适宜返回工序
(4)
 难溶于水,常温时
难溶于水,常温时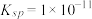 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。①欲使
 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。②20℃时,
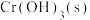 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
A.NaOH浓度越小,
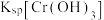 越小
越小B.x、y两点对应的溶液中
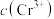 不相等
不相等C.当NaOH浓度小于
 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动D.当NaOH浓度为
 时,溶液中
时,溶液中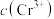 一定最小
一定最小(5)工序③也可以利用电解法制
 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
您最近一年使用:0次
2022-11-30更新
|
992次组卷
|
5卷引用:河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题 江西省宁冈中学2022-2023学年高三上学期12月月考化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题
名校
3 . 用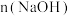 为
为 的
的 浓溶液吸收一定量的氯气,充分反应后溶液中只含有
浓溶液吸收一定量的氯气,充分反应后溶液中只含有 、
、 、
、 三种溶质。下列判断不正确的是
三种溶质。下列判断不正确的是
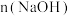 为
为 的
的 浓溶液吸收一定量的氯气,充分反应后溶液中只含有
浓溶液吸收一定量的氯气,充分反应后溶液中只含有 、
、 、
、 三种溶质。下列判断不正确的是
三种溶质。下列判断不正确的是A.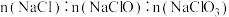 可能为9:4:1 可能为9:4:1 |
B.若反应中转移的电子的物质的量为 ,则 ,则 |
C.被吸收的氯气的物质的量为 |
D. 可能为14:9 可能为14:9 |
您最近一年使用:0次
2022-11-15更新
|
1289次组卷
|
6卷引用:河南省杞县高中2022-2023学年高一上学期网课期中检测化学试题
名校
解题方法
4 . 甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
反应ⅱ:CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
(1)反应ⅲ:CO2(g)+H2(g) CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=___________ ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施为___________ ,下列说法可以证明该反应已达到平衡状态的是___________ (填字母)。
a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按 =1:1投料。
=1:1投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是")化学平衡状态,CH4的转化率:c点>b点,原因是___________ 。

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得c(H2O)=0.040mol·L-1,则此时的反应速率v=___________ (已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=___________ [写出含有a、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
反应ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
CO(g)+3H2(g) ΔH1=+206kJ·mol-1;反应ⅱ:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。
CO2(g)+4H2(g) ΔH2=+165kJ·mol-1。(1)反应ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g)的ΔH3=
CO(g)+H2O(g)的ΔH3=a、v正(CO2)=v正(H2)
b、容器内气体压强不再改变
c、H2的浓度不再改变
d、CO和H2O的浓度之比为1∶1
(2)对于反应ⅰ,向体积为2L的恒容密闭容器中,按
 =1:1投料。
=1:1投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程v=k·cm(CH4)·c0.5(H2O),k为速率常数(只受温度影响),m为CH4的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
| 实验序号 | c(H2O)/mol·L-1 | c(CH4)/mol·L-1 | v//mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.100 | 0.200 | 2.4×10-2 |
 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应ⅰ、反应ⅱ。在恒温、恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bmol,则反应ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx= ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
2022-10-11更新
|
442次组卷
|
5卷引用:河南省九师联盟2022-2023学年高三上学期开学考试化学试题
解题方法
5 . W、X、Y、Z元素的原子序数依次增大,W、Y的最外层电子数之和等于X的内层电子数,W、Z的质子数之和与X、Y的质子数之和的差等于X的最外层电子数;W、Z形成的单质是生产、生活中应用最广的两种金属。回答下列问题:
(1)Z元素在元素周期表中的位置为_______ 。
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为_______ 。
(3)用电子式表示X形成化合物H2X的过程:_______ 。
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是_______ 。
(5)写出能体现X、Y金属性或非金属性强弱的方法:_______ (用化学方程式表示)。
(1)Z元素在元素周期表中的位置为
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为
(3)用电子式表示X形成化合物H2X的过程:
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生
 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是(5)写出能体现X、Y金属性或非金属性强弱的方法:
您最近一年使用:0次
2022-09-29更新
|
907次组卷
|
2卷引用:河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题
解题方法
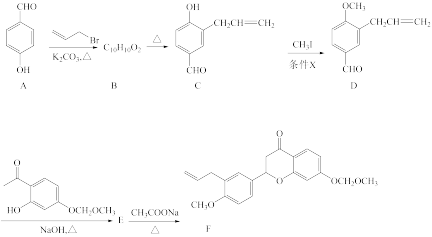
6 . 有机物F(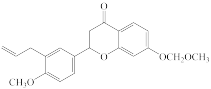 )是一种药物合成的重要中间体,其合成路线如下图所示:
)是一种药物合成的重要中间体,其合成路线如下图所示:
已知:i.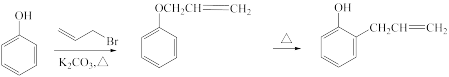 ;
;
ii.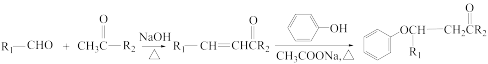
回答下列问题:
(1)A的名称为_______ ,D中含有的含氧官能团的名称为_______ 。
(2)B的结构简式为_______
(3)C→D的反应类型为_______
(4)写出D→E的化学方程式_______
(5)有机物G是B的同分异构体,符合下列条件的G有_______ 种,写出核磁共振氢谱有5组峰且面积之比为3∶2:2∶2∶1的同分异构体的结构简式_______ (仅写一种即可)。
①分子中除苯环外不含其他环状结构,苯环上有3个取代基且其中两个取代基相同;
②仅含有一种官能团,且能与新制 悬浊液反应生成砖红色沉淀。
悬浊液反应生成砖红色沉淀。
(6)下列关于有机物A的说法正确的是_______(填序号)。
 )是一种药物合成的重要中间体,其合成路线如下图所示:
)是一种药物合成的重要中间体,其合成路线如下图所示:
已知:i.
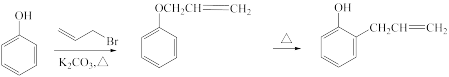 ;
;ii.
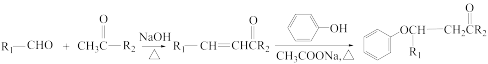
回答下列问题:
(1)A的名称为
(2)B的结构简式为
(3)C→D的反应类型为
(4)写出D→E的化学方程式
(5)有机物G是B的同分异构体,符合下列条件的G有
①分子中除苯环外不含其他环状结构,苯环上有3个取代基且其中两个取代基相同;
②仅含有一种官能团,且能与新制
 悬浊液反应生成砖红色沉淀。
悬浊液反应生成砖红色沉淀。(6)下列关于有机物A的说法正确的是_______(填序号)。
A.有机物A可与 溶液作用产生紫色沉淀 溶液作用产生紫色沉淀 |
| B.有机物A分子中所有原子可能共面 |
| C.有机物A可发生加成、取代和消去反应 |
D.1mol有机物A在一定条件下可与 发生加成反应 发生加成反应 |
您最近一年使用:0次
解题方法
7 . 电解粗铜工业得到的粗硫酸镍晶体中含有 、
、 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:

已知:①氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
②离子沉淀完全时,该离子的浓度小于 。
。
③室温下, 。
。
(1)粗硫酸镍晶体水浸后通入 的主要目的是
的主要目的是_______ 。
(2)滤渣1的主要成分是_______ ,将滤渣1充分焙烧后,再用硫酸酸化即可得到一种工业原料,该原料可用于气体水分的检验,焙烧滤渣1发生反应的化学方程式为_______ 。
(3)反应II时滴加 的作用是
的作用是_______ ,反应的离子方程式为_______ ,加入的试剂X是_______ ,调整溶液 的范围为
的范围为_______ 。
(4)若反应III中 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为_______  。
。
(5)操作IV为在_______ (填仪器名称)中加热至_______ ,冷却结晶,过滤、洗涤、干燥后得到相应的纯硫酸镍晶体。
 、
、 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
已知:①氢氧化物沉淀的
 范围如下表所示:
范围如下表所示:| 金属阳离子 |  |  |  |  |
开始沉淀的 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的 | 8.3 | 2.8 | 8.2 | 8.9 |
②离子沉淀完全时,该离子的浓度小于
 。
。③室温下,
 。
。(1)粗硫酸镍晶体水浸后通入
 的主要目的是
的主要目的是(2)滤渣1的主要成分是
(3)反应II时滴加
 的作用是
的作用是 的范围为
的范围为(4)若反应III中
 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为 。
。(5)操作IV为在
您最近一年使用:0次
8 . 乙二胺[H2N(CH2)2NH2]是一种二元弱碱,在水中的电离方式与氨相似。25℃时,用HCl调节0.10mol·L-1乙二胺溶液的pH,溶液中含氮物种的分布系数(δ)与pH的关系如图所示(如乙二胺的分布系数δ[H2N(CH2)2NH2]= )。下列说法错误的是
)。下列说法错误的是
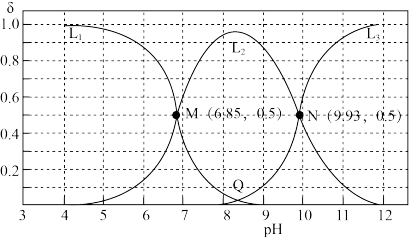
 )。下列说法错误的是
)。下列说法错误的是
A.乙二胺第一步电离的方程式为H2N(CH2)2NH2+H2O⇌H2N(CH2)2NH +OH- +OH- |
| B.曲线L3表示δ[H2N(CH2)2NH2]与pH的关系 |
| C.Q点对应溶液的pH=8.39 |
| D.M、N点溶液中c(Cl-)相等 |
您最近一年使用:0次
9 . 使用镍基电催化剂、二茂铁(简写为Cp2Fe)作牺牲电子供体,同时使用NH4PF6作电解质和质子供体,乙腈(CH3CN)作溶剂,可实现连续非水流通池中有效的催化CO2还原,装置如下图所示:

已知:
下列说法错误的是

已知:

下列说法错误的是
| A.选用乙腈作溶剂,与CO2、NH4PF6等在其中的溶解性有关 |
| B.使用的交换膜是质子交换膜 |
| C.该装置工作时,阴极上还可能有H2产生 |
D.该电池反应为2Cp2Fe+CO2+2NH4PF6 2Cp2FePF6+CO+2NH3+H2O 2Cp2FePF6+CO+2NH3+H2O |
您最近一年使用:0次
2022-07-22更新
|
1849次组卷
|
5卷引用:河南省重点高中“顶尖计划“2022届高三下学期第四次考试理综化学试题
河南省重点高中“顶尖计划“2022届高三下学期第四次考试理综化学试题浙江省宁波市镇海中学2022-2023学年高三上学期(10月)选考模拟一化学试题福建省龙岩市长汀县2023届高三下学期5月质量检测化学试题(已下线)【2023】【高二下】【十四凤起】【期中考】【高中化学】【洪翔峰收集】山东省实验中学2024届高三上学期10月一诊考试化学试题
10 . 工业上可用氨水处理硫酸厂尾气中的SO2.常温下,向一定浓度的氨水中通入SO2气体,溶液中lgx[x= 或
或 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
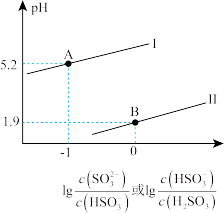
下列说法错误的是
 或
或 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
下列说法错误的是
A.曲线II代表lg |
B.当溶液的pH由7.2降到1.9的过程中,溶液中 浓度呈增大趋势 浓度呈增大趋势 |
C.当溶液中的c( ) =c(H2SO3)时,溶液的pH约为4 ) =c(H2SO3)时,溶液的pH约为4 |
D.(NH4)2SO3溶液中存在离子浓度关系:c(NH3·H2O) +c(OH-)>c(H+) +c( ) +c( H2SO3) ) +c( H2SO3) |
您最近一年使用:0次
2022-07-22更新
|
1427次组卷
|
3卷引用:河南省焦作市、安阳市普通高中2022届高三第二次模拟考试理综化学试题
河南省焦作市、安阳市普通高中2022届高三第二次模拟考试理综化学试题(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题2024届四川省内江市威远中学校高三下学期第一次模拟考试理科综合试题-高中化学



