名校
1 . 在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HCl溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
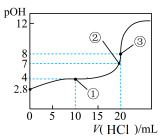
| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mol·L-1 |
您最近一年使用:0次
2019-05-24更新
|
3118次组卷
|
13卷引用:四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题【市级联考】山东省烟台市、菏泽市2019届高三下学期5月高考适应性练习(一)理科综合化学试题四川省泸县第五中学2020届高三上学期开学考试理综化学试题备考突破2020高三化学专题强化集训——盐类水解中三大守恒的应用安徽省定远县重点中学2020届高三下学期3月线上模拟考试理科综合化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 黑龙江省双鸭山市第一中学2023-2024学年高二下学期开学化学试题四川省绵阳中学2023-2024学年高二下学期开学化学试题2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷
2 . 下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
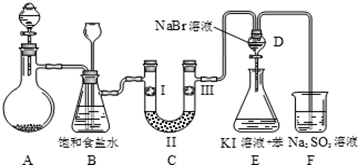
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为__________________ ;
(2)装置B中饱和食盐水的作用是__________ ,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________ ;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是______ (填编号);
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_________ ,事实上该现象并不能说明溴的非金属性强于碘,原因是__________________ (用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因________________ ;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方式____________________ 。

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是
| 编号 | A | B | C | D |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因
(6)装置F的目的是吸收余氯,试写出相应的离子反应方式
您最近一年使用:0次
3 . 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原矿石中Al2O3的质量是克
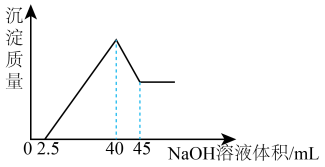

| A.5.1 | B.3.9 | C.2.55 | D.7.8 |
您最近一年使用:0次
2017-02-17更新
|
1973次组卷
|
4卷引用:四川省达州市2020-2021学年高一上学期期末考试化学试题
4 . 向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
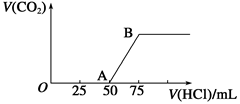

| A.OA段所发生反应的离子方程式:H++OH-==H2O; |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
您最近一年使用:0次
13-14高三上·河南南阳·期中
5 . (Ⅰ)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
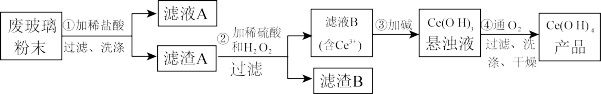
(1)洗涤的目的主要是为了除去Cl-和___________ (填离子符号),检验该滤渣A洗净的方法是___________ 。
(2)第②步反应的离子方程式是___________ 。
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为___________ 。
(Ⅱ)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
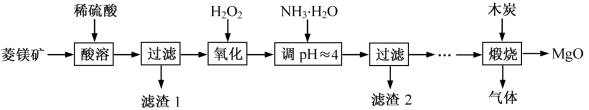
(4)加入H2O2氧化时,发生反应的化学方程式为___________ 。
(5)滤渣2的成分是___________ (填化学式)。
煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
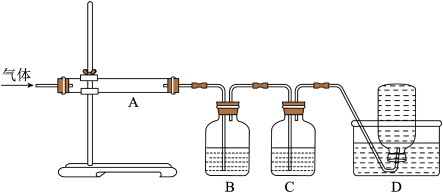
(6)①D中收集的气体可以是___________ (填化学式)。
②B中盛放的溶液可以是___________ (填字母)。
A.NaOH溶液 B.Ca(OH)2溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:___________ 。
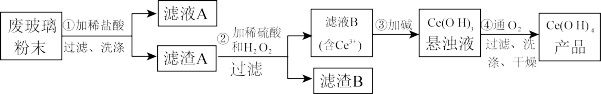
(1)洗涤的目的主要是为了除去Cl-和
(2)第②步反应的离子方程式是
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为
(Ⅱ)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(4)加入H2O2氧化时,发生反应的化学方程式为
(5)滤渣2的成分是
煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。

(6)①D中收集的气体可以是
②B中盛放的溶液可以是
A.NaOH溶液 B.Ca(OH)2溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
13-14高二上·湖北武汉·期末
名校
解题方法
6 . T℃时,将3mol A和1mol B 气体通入体积为2 L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)≒xC(g),2min时,反应达到平衡状态(温度不变),剩余0.8molB,并测得C的浓度为0.4mol/L,请回答下列问题:
(1)从开始反应至达到平衡状态,生成C的平均速率为____ 。
(2)x=____ 。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡____ (填字母)。
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
(4)若向原平衡混合物的容器中再充入a molC,在 T℃时达到新的平衡,此时B的物质的量为n(B)=____ mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为____________ 。
(1)从开始反应至达到平衡状态,生成C的平均速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡
A、向正反应方向移动 B、向逆反应方向移动 C、不移动
(4)若向原平衡混合物的容器中再充入a molC,在 T℃时达到新的平衡,此时B的物质的量为n(B)=
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
您最近一年使用:0次
2016-12-09更新
|
1899次组卷
|
4卷引用:2014-2015四川省达州市大竹县文星中学高二3月月考化学试卷
2014-2015四川省达州市大竹县文星中学高二3月月考化学试卷(已下线)2012-2013学年湖北武汉部分重点中学高二上学期期末考试化学试卷山西省平遥中学2017-2018学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 章末综合检测卷
7 . 由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Cu+的最外层核外电子排布式为_________ 。
(2)研究者预想合成一个纯粹由氮组成的新物种N5+N3-,若N5+中每个氮原子均满足8电子结构,以下有关N5+推测正确的是____ 。
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3。通过3CH4 +2(HB=NH)3+6H2O ==3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________ 。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有_________ 个σ键。
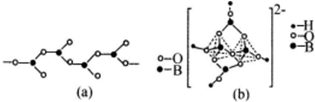
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________ 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________ 。
(5) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________ (用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________ g(氧离子的半径为1. 40×10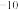 m,
m,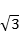 ≈l. 732)。
≈l. 732)。

(1)基态Cu+的最外层核外电子排布式为
(2)研究者预想合成一个纯粹由氮组成的新物种N5+N3-,若N5+中每个氮原子均满足8电子结构,以下有关N5+推测正确的是
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3。通过3CH4 +2(HB=NH)3+6H2O ==3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为

(5) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为
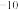 m,
m,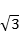 ≈l. 732)。
≈l. 732)。
您最近一年使用:0次
8 . (1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。

①判断甲容器中的反应达平衡的依据是__________ 。(填写相应编号)
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=________ ;平衡时,甲的压强P平= _____ (初始压强用P0表示)。
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率=_____________ 。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)________ C(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为_______________________________ 。
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为_______________ 。

①判断甲容器中的反应达平衡的依据是
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率=
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为
您最近一年使用:0次
2016-12-08更新
|
169次组卷
|
2卷引用:2015届四川省大竹县文星中学高三4月月考化学试卷
9 . A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是________ (选“A”或“D”)。
(2)元素C在元素周期表中的位置是_________ ,B的最高价氧化物对应的水化物的电子式为________ 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2∶2∶1,该盐的名称为________ 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为____________________________ 。
(1)A和D的氢化物中,沸点较低的是
(2)元素C在元素周期表中的位置是
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2∶2∶1,该盐的名称为
您最近一年使用:0次
2015-05-14更新
|
305次组卷
|
3卷引用:2014-2015四川省达州市大竹县文星中学高一3月月考化学试卷



