1 . A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。用元素符号或化学式回答下列问题。
(1)X在周期表中的位置是_________ ;五种元素的原子半径从大到小的顺序是____________ ;化合物Y2X2的电子式为________________ 。
(2)X、Z的简单氢化物中沸点较高的是_______ ;原因是_____________________ 。
(3)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:_________________________ ;
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:_____________ 。
(5)写出化合物Y2X2与水反应的离子方程式:_________________________ 。
(1)X在周期表中的位置是
(2)X、Z的简单氢化物中沸点较高的是
(3)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:
(5)写出化合物Y2X2与水反应的离子方程式:
您最近一年使用:0次
2 . 现有A、B、C、D、E五种原子序数依次增大的前四周期元素,A元素原子序数与周期序数相同;B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物;D是所在周期的原子序数最大的金属元素; E处于第四周期且其基态原子价层电子排布式为md2mnsn-2。请回答下列问题(用元素符号或化学式作答):

(1)BA3分子的空间构型为___ ,B、C元素的第一电离能大小关系为___ 。
(2)与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷,其晶胞结构如图,则每个晶胞中含M原子的个数为___ ,该功能陶瓷的化学式为___ 。
(3)A、C两元素形成原子个数比1∶1的化合物在酸性条件下能将E2+氧化,写出其离子方程式___ 。
(4)写出以金属D、E为两电极、NaOH溶液为电解质溶液组成原电池的负极反应式___ 。
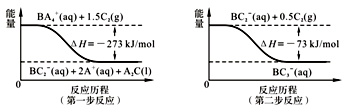
(5)已知在微生物作用的条件下,BA4+经过两步反应被氧化成BC3-。两步反应的能量变化如右图。试写出1 mol BA4+(aq)全部氧化成BC3-(aq)的热化学方程式___ 。

(1)BA3分子的空间构型为
(2)与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷,其晶胞结构如图,则每个晶胞中含M原子的个数为
(3)A、C两元素形成原子个数比1∶1的化合物在酸性条件下能将E2+氧化,写出其离子方程式
(4)写出以金属D、E为两电极、NaOH溶液为电解质溶液组成原电池的负极反应式
(5)已知在微生物作用的条件下,BA4+经过两步反应被氧化成BC3-。两步反应的能量变化如右图。试写出1 mol BA4+(aq)全部氧化成BC3-(aq)的热化学方程式

您最近一年使用:0次
名校
解题方法
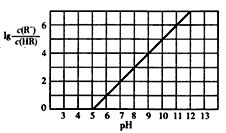
3 . 已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与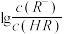 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
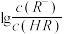 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
| A.由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10 |
| B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+) |
| C.pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+) |
| D.pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O) |
您最近一年使用:0次
2018-05-05更新
|
2288次组卷
|
7卷引用:四川省资阳中学2016-2017学年高二期末适应性考试化学试题
4 . 减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g) +O2(g) =2NO (g)△H=+180.5kJ·mol-1
C (s) +O2(g) =CO2(g)△H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: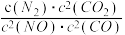 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________________ 。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______ 。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
CH2=CH2(g)+4H2O(g)已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______ (填序号)。
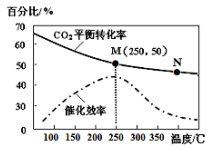
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
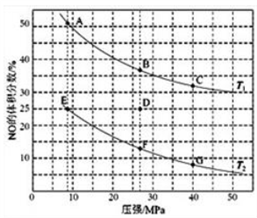
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______ (保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________ 。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______ 点。
(1)已知:N2(g) +O2(g) =2NO (g)△H=+180.5kJ·mol-1
C (s) +O2(g) =CO2(g)△H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为:
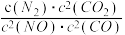 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g)已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
CH2=CH2(g)+4H2O(g)已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的
您最近一年使用:0次
2017-05-21更新
|
808次组卷
|
5卷引用:四川省资阳市高中(2018届)2015级高三课改实验班12月月考理综化学试题
5 . 将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。
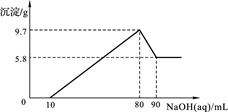
(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
您最近一年使用:0次
2016-12-09更新
|
1362次组卷
|
5卷引用:2014-2015四川省资阳市高一上学期学期期末化学试卷
6 . 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质。图中:①为氯气发生装置;②试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;③试管里是滴有酚酞的NaOH溶液;④为尾气吸收装置。请填写下列空白:
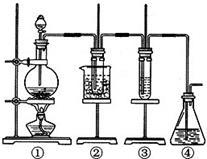
(1)实验前必须对整套装置进行的操作是_______________________ ;
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________ (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有__________ (填写下列编号字母)的净化装置。
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)写出②装置中发生的离子反应方程式___________________ ;
(4)实验中可观察到③试管的实验现象是溶液褪色。某同学提出两种猜想:
猜想一:氯气与NaOH溶液发生反应使溶液褪色
猜想二:__________________________________________ 。
请设计实验验证哪种猜想是正确的?
__________________________ 。

(1)实验前必须对整套装置进行的操作是
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)写出②装置中发生的离子反应方程式
(4)实验中可观察到③试管的实验现象是溶液褪色。某同学提出两种猜想:
猜想一:氯气与NaOH溶液发生反应使溶液褪色
猜想二:
请设计实验验证哪种猜想是正确的?
您最近一年使用:0次
2016-12-09更新
|
568次组卷
|
2卷引用:2014-2015四川省资阳市高一上学期学期期末化学试卷
7 . Q、R、X、Y、Z五种元素的原子序数依次递增。已知:① Z的原子序数为29,而Q、R、X、Y均为短周期主族元素;② R原子有3个未成对电子;③ Q、X原子p轨道的电子数分别为2和4;④ Y原子价电子(外围电子)排布为msnmpn。请回答下列问题:
(1)R的氢化物RH3中R采取______ 杂化,其键角_____ 109°28′(选填“>”、“=”或者“<”)。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是(选填字母代号)_____ 。
a.稳定性:甲>乙;沸点:甲>乙
b.稳定性:甲>乙;沸点:甲<乙
c.稳定性:甲<乙;沸点:甲<乙
d.稳定性:甲<乙;沸点:甲>乙
(3)下列与H2X分子互为等电子体的微粒有(选填字母代号)______ 。
a.CH4 b.H2S c.NO2 d.NH2-
(4)由X和Y形成的化合物属于________ 晶体(填晶体类型),30 g该晶体中有_____ mol共价键。
(5)Z是____ (填元素符号),它位于周期表的______ 区,其晶体的三维堆积模型见下图,

称之为面心立方最密堆积,其配位数为_____ 。Z2+的外围电子排布式是____________ 。1个Z2+与4个RH3以配位键结合形成_________________ 离子(填化学式)。
(1)R的氢化物RH3中R采取
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是(选填字母代号)
a.稳定性:甲>乙;沸点:甲>乙
b.稳定性:甲>乙;沸点:甲<乙
c.稳定性:甲<乙;沸点:甲<乙
d.稳定性:甲<乙;沸点:甲>乙
(3)下列与H2X分子互为等电子体的微粒有(选填字母代号)
a.CH4 b.H2S c.NO2 d.NH2-
(4)由X和Y形成的化合物属于
(5)Z是

称之为面心立方最密堆积,其配位数为
您最近一年使用:0次



