1 . 以红土镍矿 主要成分为
主要成分为 、
、 、
、 、
、 和
和 等
等 为原料制备
为原料制备 的工艺流程如图:
的工艺流程如图:
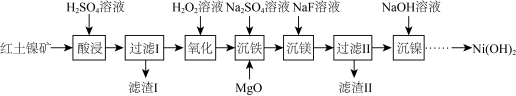
(1)“酸浸”时,加快化学反应速率的措施_______  写一条即可
写一条即可 ,滤渣Ⅰ的成分为
,滤渣Ⅰ的成分为_______  填化学式
填化学式 。
。
(2)“氧化”时, 发生反应的离子方程式为
发生反应的离子方程式为_______ ,若用 代替
代替 溶液,使
溶液,使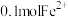 转化为
转化为 ,则需
,则需 至少为
至少为_______  。
。
(3) 的作用是调节溶液
的作用是调节溶液 使
使 沉淀,根据下表的数据,则调节溶液
沉淀,根据下表的数据,则调节溶液 的范围是
的范围是_______ 。
(4)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是_______ 。
(5)金属 可以与
可以与 、
、 形成一种化合物M,M是一种新型超导体,它的临界温度为
形成一种化合物M,M是一种新型超导体,它的临界温度为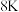 。已知
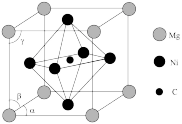
。已知 的晶胞
的晶胞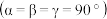 结构如图所示,则
结构如图所示,则 的化学式为
的化学式为_______ 。原子A和B的位置分别为(0,0,0),(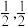 ,0),原子C的位置为
,0),原子C的位置为_______ 。 用坐标表示
用坐标表示
 主要成分为
主要成分为 、
、 、
、 、
、 和
和 等
等 为原料制备
为原料制备 的工艺流程如图:
的工艺流程如图:
(1)“酸浸”时,加快化学反应速率的措施
 写一条即可
写一条即可 ,滤渣Ⅰ的成分为
,滤渣Ⅰ的成分为 填化学式
填化学式 。
。(2)“氧化”时,
 发生反应的离子方程式为
发生反应的离子方程式为 代替
代替 溶液,使
溶液,使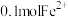 转化为
转化为 ,则需
,则需 至少为
至少为 。
。(3)
 的作用是调节溶液
的作用是调节溶液 使
使 沉淀,根据下表的数据,则调节溶液
沉淀,根据下表的数据,则调节溶液 的范围是
的范围是| 金属离子 |  |  |  |  |
开始沉淀的 | 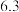 |  |  |  |
沉淀完全的 |  |  | 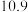 |  |
(5)金属
 可以与
可以与 、
、 形成一种化合物M,M是一种新型超导体,它的临界温度为
形成一种化合物M,M是一种新型超导体,它的临界温度为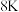 。已知
。已知 的晶胞
的晶胞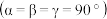 结构如图所示,则
结构如图所示,则 的化学式为
的化学式为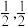 ,0),原子C的位置为
,0),原子C的位置为 用坐标表示
用坐标表示

您最近一年使用:0次
名校
解题方法
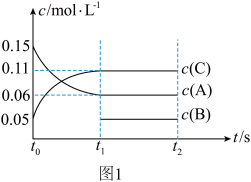
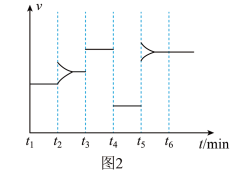
2 . 一定条件下向某密闭容器中加入 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是
 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前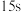 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为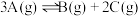 |
C.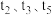 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为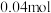 |
您最近一年使用:0次
2023-01-17更新
|
849次组卷
|
21卷引用:四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题
四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题山西省实验中学2018届高三上学期学业质量监测化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高二上学期期中联考化学试题天津市七校2019-2020学年高二上学期期中联考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析(提升练)黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山西省运城市景胜中学2020-2021学年高二10月月考化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题
名校
3 . 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入 稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发)。下列说法不正确 的是( )
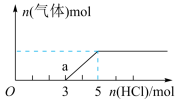

| A.通入CO2气体的体积在标准状况下为22.4 L |
| B.O到a点发生反应的离子方程式:H++OH—=H2O、CO32—+H+=HCO3— |
| C.O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| D.NaOH溶液的物质的量浓度为2.5 mol•L—1 |
您最近一年使用:0次
2019-11-24更新
|
2219次组卷
|
8卷引用:四川省华蓥中学2022-2023学年高一下学期2月月考化学试题
4 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):不正确 的是

| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2019-04-12更新
|
7415次组卷
|
49卷引用:四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题
四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题2019年4月浙江省普通高校招生选考科目考试化学试题天津市第一中学2018-2019学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2020届高三11月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算 高考帮安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过高考 3年真题强化闯关(已下线)【浙江新东方】97(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练选择性必修1(SJ)专题1专题培优专练(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题(已下线)专题10.化学反应中的能量变化-十年(2012-2021)高考化学真题分项汇编(浙江专用)湖北省石首市2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)河南省信阳市2021-2022学年高二上学期期中考试化学试题第一章 综合拔高练(已下线)高中化学-高二上-9(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题天津市区重点中学2023届高三毕业班联考(一)化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷(已下线)专题08 化学反应中的能量变化(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨第三中学2023-2024学年高二上学期第二次验收考试化学试题
5 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:四川省邻水实验学校2022届高三上学期入学考试理综化学试题
四川省邻水实验学校2022届高三上学期入学考试理综化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题青海省西宁二十一中2018届高三上学期12月月考化学试卷黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
6 . X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)_______________________ 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)____________________ 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:
B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:________ ;D的电子式:________ 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________________ ;由A转化为B的离子方程式为______________________ 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:_________________________________ 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是_________________ ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有___________ 。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
 B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:
B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:
您最近一年使用:0次
2019-01-30更新
|
2080次组卷
|
6卷引用:四川省广安市第二中学2019届高三上学期第一次月考化学试题
四川省广安市第二中学2019届高三上学期第一次月考化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)(已下线)2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(已下线)2014届高考化学二轮复习必做训练 物质结构、元素周期律练习卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷百所名校联考-物质结构 元素周期律
解题方法
7 . 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:

(1)Ⅱ相对于Ⅰ的优点是______________________________ 。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________ 。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________ 。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________ (可以写表达式)。
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸 |

(1)Ⅱ相对于Ⅰ的优点是
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=
您最近一年使用:0次
解题方法
8 . 有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
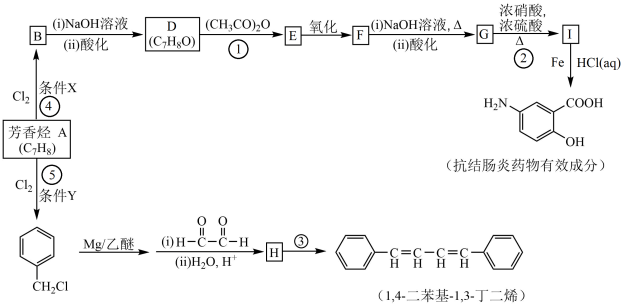
已知:
Ⅰ.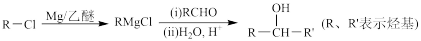
Ⅱ.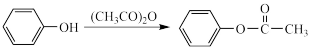
Ⅲ.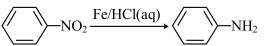
Ⅳ.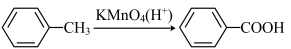
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是______ 。
(2)D的结构简式是_______________
(3)写出F与NaOH反应的化学方程式______ 。
(4)下列说法正确的是________ (填选项字母)。
(5)检验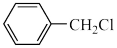 有氯原子的方法是
有氯原子的方法是______ 。
(6)③的化学方程式是______ 。
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式:______ 。
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3∶2∶2

已知:
Ⅰ.
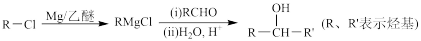
Ⅱ.
Ⅲ.
Ⅳ.
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是
(2)D的结构简式是
(3)写出F与NaOH反应的化学方程式
(4)下列说法正确的是
| A.④的反应条件X和⑤的反应条件Y完全相同 |
| B.①②④⑤反应类型相同 |
| C.G不可以发生缩聚反应 |
| D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化 |
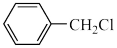 有氯原子的方法是
有氯原子的方法是(6)③的化学方程式是
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3种峰,峰面积之比为3∶2∶2
您最近一年使用:0次
名校
9 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3617次组卷
|
21卷引用:四川省广安市第二中学2019届高三上学期第一次月考化学试题
四川省广安市第二中学2019届高三上学期第一次月考化学试题2016届辽宁省沈阳市第二中学高三10月月考化学试卷2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题辽宁省实验中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题



