名校
1 . 图(Ⅰ)和图(Ⅱ)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。下列说法正确的是

| A.[H3NCH2CH2NH3]A溶液显碱性 |
B.[H3NCH2CH2NH2]HA溶液中存在关系式: 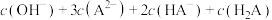 |
C.[H3NCH2CH2NH2][HA]溶液中各离子浓度大小关系为: |
D.向[H3NCH2CH2NH2][HA]溶液中通入一定量的HCl气体,则 可能增大也可能减小 可能增大也可能减小 |
您最近一年使用:0次
2 . 常温下,分别在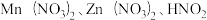 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 ,X代表
,X代表 、
、 、
、 、
、 与pH关系如图所示。已知:
与pH关系如图所示。已知: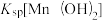 >
>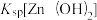 。下列叙述正确的是
。下列叙述正确的是
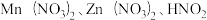 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 ,X代表
,X代表 、
、 、
、 、
、 与pH关系如图所示。已知:
与pH关系如图所示。已知: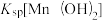 >
>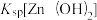 。下列叙述正确的是
。下列叙述正确的是
A.图中 代表: 代表: 与pH的关系, 与pH的关系,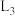 代表 代表 与pH的关系 与pH的关系 |
B.同时产生两种沉淀时, |
C.再向体系中加入硫化钠溶液, 减少, 减少,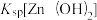 将变小 将变小 |
D. 的平衡常数 的平衡常数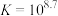 |
您最近一年使用:0次
3 . 工业上利用锌焙砂(主要成分为  ,含有少量
,含有少量 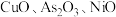 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
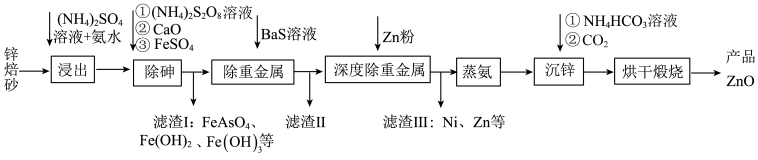
(1)用足量 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是___________ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)“浸出”时 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为___________
(3)“除重金属”时,加入 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是___________ 和  。
。
(4)“蒸氨”时会出现白色固体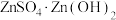 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为___________ 。
(6)煅烧”步骤中,在一定温度下,煅烧 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为___________  (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。
(7)该流程中可循环利用的物质有___________ (答出任意 2 种即可)
 ,含有少量
,含有少量 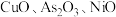 等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量
 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为(3)“除重金属”时,加入
 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
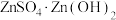 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为(6)煅烧”步骤中,在一定温度下,煅烧
 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为 (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。(7)该流程中可循环利用的物质有
您最近一年使用:0次
名校
解题方法
4 . 氧钒(Ⅳ)碱式碳酸铵晶体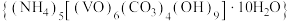 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
 溶液
溶液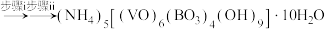
步骤i:用 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。
步骤ii:待反应结束后,在 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
(1)仪器E的名称为________ ;上述装置连接的顺序为________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)①预测 保护气排除氧气的目的是
保护气排除氧气的目的是________ ;判断装置中的 基本上排尽的方法是
基本上排尽的方法是________ (填实验现象)。
②晶体用无水乙醇代替水洗涤的目的是________ 。
(4)称bg粗品,用 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用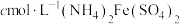 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为 )。
)。
I.配制 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为________ (填序号)。 溶液的体积为
溶液的体积为________ ;产品中钒的质量分数为________ %(用含b、c、M的代数式表示)。
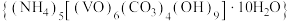 是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。
是制备多种含钒产品的前驱体。已知:氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇。实验室制备该晶体的流程如图所示。 溶液
溶液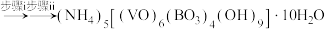
步骤i:用
 排除装置中的氧气,将
排除装置中的氧气,将 溶液缓慢加入足量
溶液缓慢加入足量 溶液中,有气泡产生,析出紫红色晶体。
溶液中,有气泡产生,析出紫红色晶体。步骤ii:待反应结束后,在
 保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和
保护气的环境中,将混合液静置一段时间,抽滤,所得晶体用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。
溶液洗涤3次,再用无水乙醇洗涤2次,得到粗产品。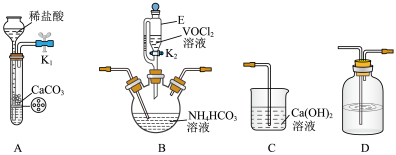
(1)仪器E的名称为
(2)装置B中发生反应的化学方程式是
(3)①预测
 保护气排除氧气的目的是
保护气排除氧气的目的是 基本上排尽的方法是
基本上排尽的方法是②晶体用无水乙醇代替水洗涤的目的是
(4)称bg粗品,用
 溶液氧化,再除去多余的
溶液氧化,再除去多余的 (方法略),滴入2滴
(方法略),滴入2滴 溶液,最后用
溶液,最后用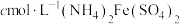 标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为
标准溶液滴定,滴定终点消耗标准溶液的体积如下图(已知钒的相对原子质量为M,滴定反应为 )。
)。I.配制
 标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为
标准溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签,下列图示中,操作①②分别为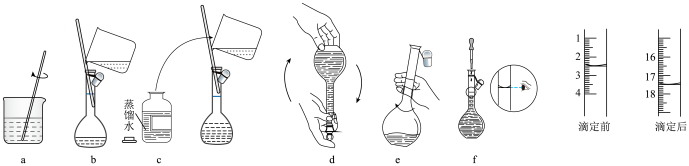
 溶液的体积为
溶液的体积为
您最近一年使用:0次
2024-06-04更新
|
170次组卷
|
2卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学
名校
5 . 配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。 的核外电子的运动状态有
的核外电子的运动状态有________ 种,配合物X中 的配体有
的配体有________ ,茜素的水溶性较好的主要原因是________ 。
(2)Ni与CO形成的配合物 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为________ (填“极性”或“非极性”)分子,分子中 键与
键与 键的个数之比为
键的个数之比为________ 。
(3)向 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体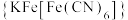 。实验表明,
。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。________ 实验,可确定该晶体结构。
② 的配位数为
的配位数为________ 。
③若 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的________ ;一个Ⅱ型立方结构中含________ 个 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为________ 。
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。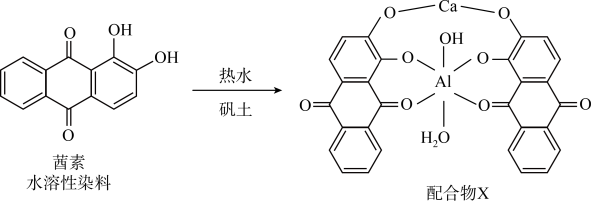
 的核外电子的运动状态有
的核外电子的运动状态有 的配体有
的配体有(2)Ni与CO形成的配合物
 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为 键与
键与 键的个数之比为
键的个数之比为(3)向
 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体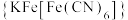 。实验表明,
。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。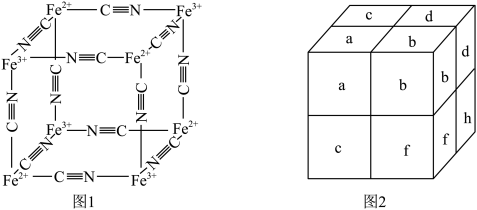
②
 的配位数为
的配位数为③若
 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
您最近一年使用:0次
6 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
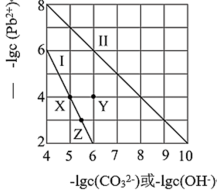
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近一年使用:0次
7 . 短周期元素A、B、C、D的原子序数依次增大,A元素原子的核外电子只有一种运动状态:基态B原子s能级的电子总数比p能级的多1;基态C原子中成对电子数是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题
(1)B原子的轨道表示式___________ 。
(2)A和C原子个数比为1∶1的化合物的电子式___________ 。
(3)元素A、B、C中,第一电离能最大的是___________ (填元素名称)。
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是___________ 。(填离子符号)
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是___________ 。
(6)BC₃的空间结构为___________ 。
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为___________ pm(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
(1)B原子的轨道表示式
(2)A和C原子个数比为1∶1的化合物的电子式
(3)元素A、B、C中,第一电离能最大的是
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是
(6)BC₃的空间结构为
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm
 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。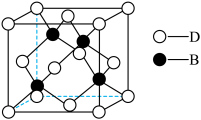
您最近一年使用:0次
解题方法
8 . 肼为二元弱碱,在水中的电离方式与氨相似。常温下,向一定浓度肼 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为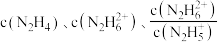 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是
 水溶液中通入
水溶液中通入 (忽略溶液体积变化),测得
(忽略溶液体积变化),测得 与
与 [X为
[X为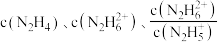 ]的变化关系如图所示。下列说法正确的是
]的变化关系如图所示。下列说法正确的是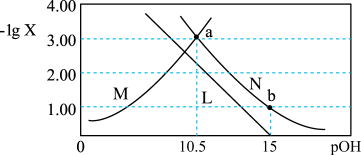
A.曲线N表示 与 与 的变化关系 的变化关系 |
B.常温下,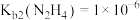 |
C.a点溶液中: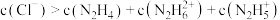 |
D.b点溶液中: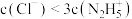 |
您最近一年使用:0次
2024-04-16更新
|
296次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
9 . 缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液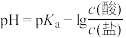 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,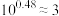 。
。
下列叙述正确的是
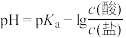 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,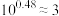 。
。下列叙述正确的是
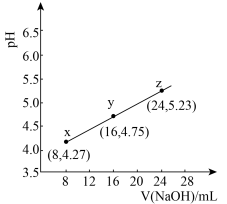
A.常温下,丙酸电离常数 的数量级为 的数量级为 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中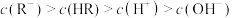 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
您最近一年使用:0次
2024-04-05更新
|
67次组卷
|
2卷引用:四川省成都电子科技大学实验中学2023-2024学年高二上学期期末模拟化学试题
10 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: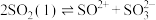 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中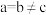 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则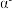 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
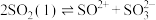 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是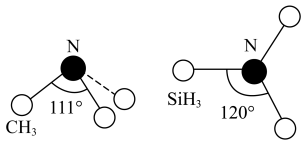
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。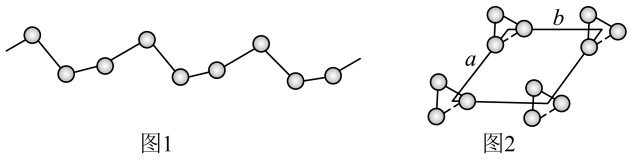
 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次



