名校
解题方法
1 . 一定条件下向某密闭容器中加入 、
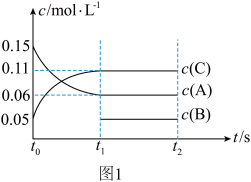
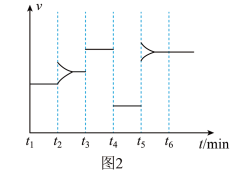
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是
 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前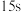 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为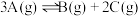 |
C.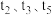 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为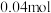 |
您最近一年使用:0次
2023-01-17更新
|
851次组卷
|
21卷引用:山西省实验中学2018届高三上学期学业质量监测化学试题
山西省实验中学2018届高三上学期学业质量监测化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高二上学期期中联考化学试题天津市七校2019-2020学年高二上学期期中联考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析(提升练)黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山西省运城市景胜中学2020-2021学年高二10月月考化学试题四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH 、Al3+、CO
、Al3+、CO 、AlO
、AlO 、S2O
、S2O 、SO
、SO 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
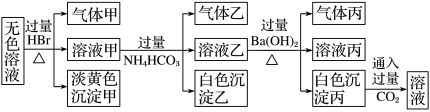
下列说法不正确的是
 、Al3+、CO
、Al3+、CO 、AlO
、AlO 、S2O
、S2O 、SO
、SO 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
下列说法不正确的是
| A.淡黄色沉淀甲不可能为AgBr |
| B.气体甲可能是混合气体 |
C.综合上述信息可以确定肯定存在的离子有:Na+、AlO 、S2O 、S2O |
D.由溶液甲生成气体乙的途径只有:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
您最近一年使用:0次
11-12高一·江西·阶段练习
名校
解题方法
3 .  、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为
 、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为| A.22∶1∶14 | B.29∶8∶13 | C.26∶8∶57 | D.13∶8∶29 |
您最近一年使用:0次
2022-01-03更新
|
2582次组卷
|
34卷引用:四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题
四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】四川省成都市双流区棠湖中学2018-2019学年高一上学期第一次月考化学试题(已下线)2012-2013学年江西省四校高一零班第一次月考化学试卷(已下线)2013-2014黑龙江省哈六中高二下学期期末考试化学试卷(已下线)2014-2015学年河南省方城县第一高级中学高一10月月考化学试卷2015-2016学年浙江省余姚中学高一上10月月考化学试卷2015-2016学年辽宁省辽阳一中高一上学期9月教学质检化学试卷2015-2016学年内蒙古集宁一中高一上第一次月考化学试卷2016-2017学年河北省廊坊一中高一上学期第一次月考化学试卷2016-2017学年河北省定州中学高二(承智班)下学期开学考试化学试卷辽宁省葫芦岛市第一中学2017-2018学年高一上学期第一次月考化学试题辽宁省葫芦岛市第一高级中学2017-2018学年高一上学期第一次月考化学试题江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】湖南省衡阳县第四中学2019届高三第一次月考(9月)化学试题【校级联考】湖北省重点高中协作体2018-2019学年高一上学期期中联考化学试题吉林省白城市通榆县第一中学2019-2020学年高一上学期第一次月考化学试题河南省鲁山县第一高级中学2019-2020学年高一9月月考化学试卷试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高一上学期期中考试化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高一上学期第一次阶段考试化学试题吉林省长春市东北师大附中净月校区2019-2020学年高一12月月考化学试题湖南省株洲市攸县三中2019-2020学年高一上学期第一次月考化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用(提升练)(已下线)【南昌新东方】江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题贵州省毕节市威宁第四中学2022届高三第一次月考化学试题黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题福建省厦门外国语学校石狮分校2021-2022学年高一上学期第一次月考化学试题福建省师范大学附属中学2021–2022学年高一上学期期中考试化学试题上海市进才中学2022-2023学年高一上学期期中考试化学试题上海师范大学附属中学2022-2023学年高一上学期期中考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题
10-11高二·江西上饶·阶段练习
4 . 在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol)
2NH3(g) ∆H=-92.4kJ/mol)
下列说法正确的是
 2NH3(g) ∆H=-92.4kJ/mol)
2NH3(g) ∆H=-92.4kJ/mol)| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
| NH3浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A.2c1>c3 | B.a+b=92.4 | C.2p1<p3 | D.a2+a3>1 |
您最近一年使用:0次
2021-10-20更新
|
2015次组卷
|
25卷引用:2015-2016学年四川省新津中学高二10月月考化学试卷
2015-2016学年四川省新津中学高二10月月考化学试卷(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷2016-2017学年黑龙江省铁人中学高二上开学测化学卷湖北省沙市中学2017-2018学年高二上学期期中考试化学试题安徽省淮南市第二中学2017-2018学年高二上学期第二次月考化学试题内蒙古北京八中乌兰察布分校2017-2018学年高二下学期第二次调研考试化学试题【全国百强校】宁夏回族自治区银川市第一中学2018-2019学年高二上学期期末考试化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题百所名校联考-选修四模块综合检测步步为赢 高二化学寒假作业:作业六 化学平衡中的模型构建与等效平衡云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理—— 转化率与产率的相关计算2020届高三化学选修4二轮专题练——等效平衡专练【精编23题】鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化—工业合成氨山东省临沂市沂水一中2020-2021学年高二9月月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题山西省运城市景胜中学2020-2021学年高二10月月考化学试题黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题天津市咸水沽第二中学2021-2022学年高二上学期第一次月考化学试题福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)第七单元 化学反应速率与化学平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)江西省吉安市峡江中学2021-2022学年高二上学期开学考试化学(理科)试题浙江省宁波市镇海中学2022-2023学年高三上学期(10月)选考模拟一化学试题
解题方法
5 . 氮化物应用广泛,如叠氮化钠(NaN3)是典型的高能量密度含能材料,氮化硼是特殊的耐磨和切削材料,氮化铬、氮化钼等过渡金属氮化物常用作高强度材料。回答下列问题:
(1)Na、N、B中,原子半径由大到小的顺序是___________ 。
(2)基态N原子价层电子的电子排布图为___________ 。基态铬原子核外未成对电子数为___________ 。
(3)NaN3中阴离子N 是直线型离子。1个N
是直线型离子。1个N 中的σ键数目为
中的σ键数目为___________ 。分子或离子中的大π键可用符号Π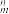 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π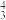 ),则N
),则N 中的大π键应表示为
中的大π键应表示为___________ 。
(4)石墨型(BN)x转变为金刚石型(BN)x时,B原子的杂化轨道类型由___________ 变为___________ 。金刚石型(BN)x的硬度比金刚石大,推测其原因是___________ 。
(5)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
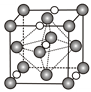
氮化钼的化学式为___________ ,如果让Li+填入氮化钼晶体的八面体空隙,一个晶胞最多可以填入___________ 个Li+。氮化钼晶胞边长为a nm,晶体的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)Na、N、B中,原子半径由大到小的顺序是
(2)基态N原子价层电子的电子排布图为
(3)NaN3中阴离子N
 是直线型离子。1个N
是直线型离子。1个N 中的σ键数目为
中的σ键数目为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π ),则N
),则N 中的大π键应表示为
中的大π键应表示为(4)石墨型(BN)x转变为金刚石型(BN)x时,B原子的杂化轨道类型由
(5)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
您最近一年使用:0次
名校
6 . 钪是地壳中含量极少的稀土元素,但在照明、合金和陶瓷材料、催化化学等领域具有重要应用价值。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如下:

回答下列问题:
(1)“酸浸”时,为提高浸取效率,可以采取的措施有___________ (答两个)。滤渣1的主要成分是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
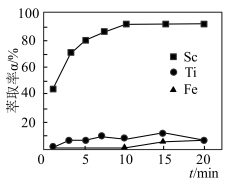
(3)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时适宜的振荡时间为___________ min。“洗钛”所得[TiO(H2O2)]2+为橘黄色的稳定离子,其中氧的化合价有-2、-1两种,则Ti的化合价为___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol/L,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的pH范围是___________ 。
已知:当离子浓度减小至10-5 mol/L时可认为沉淀完全。lg2=0.3;室温下TiO2+完全沉淀的pH为1.05,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33。
(5)加草酸“沉钪”的离子方程式为___________ 。
(6)“沉钪”后获得Sc2O3的方法是___________ ,该反应产生的气体必须回收利用,其意义是___________ 。

回答下列问题:
(1)“酸浸”时,为提高浸取效率,可以采取的措施有
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(3)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时适宜的振荡时间为

(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol/L,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的pH范围是
已知:当离子浓度减小至10-5 mol/L时可认为沉淀完全。lg2=0.3;室温下TiO2+完全沉淀的pH为1.05,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33。
(5)加草酸“沉钪”的离子方程式为
(6)“沉钪”后获得Sc2O3的方法是
您最近一年使用:0次
2021-01-07更新
|
1948次组卷
|
7卷引用:四川省自贡市田家炳中学2021届高三12月月考化学试题
四川省自贡市田家炳中学2021届高三12月月考化学试题四川省绵阳南山中学2021-2022学年高三上学期入学考试理综化学试题四川省泸州市泸县第四中学2022届高三三诊模拟考试理科综合化学试题四川省绵阳市梓潼中学校2023-2024学年高三上学期入学考试理科综合化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)工业流程题
名校
解题方法
7 . 常温下,向1L 1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
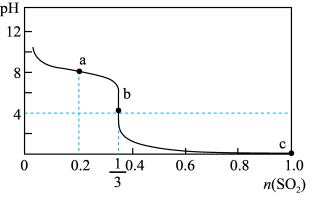

| A.常温下,HClO电离平衡常数的数量级为10﹣8 |
| B.a点溶液中存在 4c(Cl-)=c(HClO)+c(ClO-) |
C.b点溶液中存在c(Na+)>c(SO )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
| D.c点溶液中c(H+)=2mol/L |
您最近一年使用:0次
2020-11-12更新
|
1729次组卷
|
5卷引用:四川省阆中中学2021届高三上学期开学考试化学试题
10-11高二上·吉林·期中
名校
解题方法
8 . 在容积恒定的密闭容器中充入2molA和1molB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
 xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )| A.只能为2 | B.只能为3 |
| C.可能为2,也可能为3 | D.无法确定 |
您最近一年使用:0次
2020-10-31更新
|
1298次组卷
|
19卷引用:四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题
四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题(已下线)2010年吉林省吉林一中高二上学期期中考试化学试题(已下线)2015届甘肃省肃南县第一中学高三10月月考理综化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷山西省太原市山西大学附属中学2015-2016学年高二下2月模块诊断化学卷2016-2017学年河南省漯河中学高二上第一次月考化学卷河北省张家口市第一中学2016-2017学年高一(衔接班)下学期期末考试(理)化学试题2018版化学(苏教版)高考总复习专题七增分补课7--化学平衡分析中的虚拟过程--化学反应的方向和限度辽宁省辽阳2017-2018学年高二化学上学期期末考试题河南省安阳县第一高级中学2017-2018学年高二上学期第三次月考化学试卷河北省安平中学2019届高三上学期第五次月考化学试题【市级联考】福建省三明市2019届高三上学期期末质量检测化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题北京二中2020-2021学年高二上学期10月月考化学试题河北省邢台市第二中学2021届高三上学期第四次月考化学试题河南省延津第一高级中学2021-2022学年高二上学期第五次考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 25℃时, 用0.10mol/L的氨水滴定10.00mL 0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
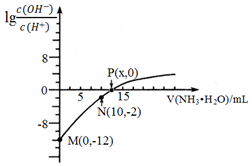
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
| A.H2A为强电解质,是一种强酸 |
| B.M、N、P三点的溶液中,水电离程度最大的是N点 |
C.P点溶液中,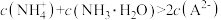 |
| D.25℃时,氨水的电离平衡常数:K=10-7/(0.2x-1) |
您最近一年使用:0次
2020-09-07更新
|
1701次组卷
|
2卷引用:四川省内江市第六中学2021届高三上学期10月月考化学试题
名校
10 . 常温下,向10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH•H2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;已知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O]=l.60×l0-4。下列说法正确的是( )


| A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L |
| B.从a到c的过程中,水的电离程度最大的是b点 |
| C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-) |
| D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NH•H2O] |
您最近一年使用:0次
2020-06-05更新
|
1418次组卷
|
3卷引用:四川省广汉中学2021届高三上学期第一次阶段考试化学试题



