四川省广汉中学2021届高三上学期第一次阶段考试化学试题
四川
高三
阶段练习
2020-10-31
439次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、初中衔接知识点、化学反应原理
四川省广汉中学2021届高三上学期第一次阶段考试化学试题
四川
高三
阶段练习
2020-10-31
439次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、初中衔接知识点、化学反应原理
一、单选题 添加题型下试题
1. 化学在日常生活中应用十分广泛,下列说法中正确的是
| A.工业生产葡萄酒时,可向酒中加入一定量的SO2 |
| B.测定水中的溶氧量,可监测水质的优劣,溶氧量越低的水质越好 |
| C.天然脂肪并不是高分子化合物,而是一种相对分子质量较大的化合物,可用纯碱溶液清除 |
| D.将久戴发黑的银首饰置于盛装盐水的铝制器皿中浸泡,又能重新光亮起来,且在处理过程中质量不会改变 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
2. NA表示阿伏加 德罗常数,则下列说法中正确的是
| A.等质量的CO和N2所含有的分子数目相同,均为NA |
B.相同温度下,体积均为1 L,浓度分别为1 mol / L和2 mol / L的Na2CO3溶液中,CO 的数目比为1:2 的数目比为1:2 |
| C.标准状况下,2.24LCl2充分反应后,转移的电子数目为0.2 NA |
| D.90g葡萄糖的乙酸溶液中含有的氧原子数为3 NA |
您最近一年使用:0次
3. 下列实验能达到实验目的的是
| A.将含有乙醇、乙酸杂质的乙酸乙酯加入长颈漏斗中,再加入饱和碳酸钠溶液,振荡、分液,可以除去大部分杂质 |
| B.用排饱和食盐水的方法收集二氧化碳气体 |
| C.用向上排空气法收集铜与浓硝酸反应制得的气体 |
| D.向蔗糖溶液中加稀硫酸,加热、冷却后的溶液中加入新制氢氧化铜悬浊液煮沸,检验其水解的产物 |
【知识点】 物质的分离、提纯 常见气体的制备与收集解读 有机物的检验解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
4. 酚酞是一种常见的酸碱指示剂,在水溶液中存在下列电离平衡:
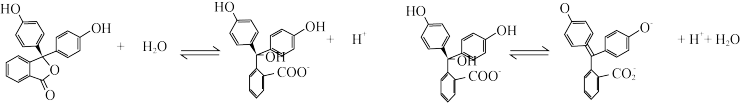
下列说法中正确的是
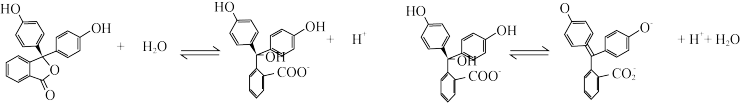
下列说法中正确的是
A.在酸溶液中,酚酞呈无色时,其化学式为:C20H12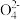 |
| B.1 mol酚酞在足量的NaOH溶液中完全反应时,最多可消耗NaOH的量为2 mol |
| C.1 mol酚酞最多可以与10 mol氢气发生加成反应 |
| D.酚酞除可指示溶液的酸碱性外,也可用于指示Fe3+的存在 |
【知识点】 酚类的化学性质 含酯基有机物水解消耗NaOH的量的计算解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
5. 下列说法中正确的是
A.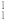 H216O和重水 H216O和重水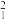 H218O是同分异构体 H218O是同分异构体 |
| B.乙炔、苯、立方烷都符合通式CnHn,因此它们是同系物。 |
| C.分子式为C9H12的某烃,与浓硫酸和浓硝酸组成的混合酸在加热条件下发生了反应,产物中分离出了4种符合C9H11NO2的有机物,则符合此反应的C9H12的所有同分异构体中,属于苯的同系物的只有3种。 |
D.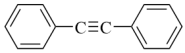 中最少都有16个原子处于同一平面上 中最少都有16个原子处于同一平面上 |
【知识点】 同系物 同分异构体书写 苯的同系物 苯的同系物的硝化反应解读
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
6. U、V、W、X、Y是原子序数依次增大的五种短周期元素,质子数之和39,V、W同周期,U、X同主族,U、W能形成两种液态化合物U2W和U2W2。Y元素的周期序数与主族序数相等。下列说法中正确的是
| A.简单离子半径:X>Y>W |
| B.XYU4中有离子键,其YU4原子团的空间构型是正四面体,在潮湿的空气中会变质而产生H2 |
| C.U、V、W、X形成的一种离子化合物,与W、X、Y组成的盐溶液相遇时,会产生大量的气泡 |
| D.1 mol X的淡黄色化合物,投入到1 L 2mol / L的氯化亚铁溶液中,产生的气体在标准状况下的体积为5.6 L |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 下列关于硫酸铜的说法正确的是
| A.蓝色硫酸铜晶体放入浓硫酸中,沉在底部变为了白色粉末,这是由于浓硫酸具有脱水性 |
| B.将一块打碎后的硫酸铜晶体残片,放入盛硫酸铜饱和溶液的孤立体系中,一段时间后取出观察,又具有规则的几何外形了,称其质量也增加了 |
| C.向硫酸铜溶液中投入绿豆大小的金属钠,钠块游动并着火燃烧,反应完成后,发现有蓝色并夹杂黑色颗粒的絮状沉淀生成,着火并产生黑色颗粒表明,取用钠块时,没有用滤纸吸干其表面的煤油 |
| D.硫酸铜溶液与纯碱溶液混合时,有绿色沉淀生成,说明CuCO3固体为绿色 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
8. 合成绿色能源,消除环境污染,是新时代化学研究的热点课题,在这一领域的研究中,电化学可以大有作为。右面就是一种利用氢气来消除CO、NH3、NO等对境污染气体的电化学装置,在消除污染气体的同时,还可获得绿色能源甲醇,以及化工产品KOH(aq)和H2SO4溶液等。下列说法中错误的是


| A.消除CO污染的工作池内要先加入稀硫酸,以提供合成甲醇所需的原料 |
| B.从B、C出口逸出的气体相同,都是空气中含量最多的气体 |
| C.从A、D出口分别获得的化工产品是硫酸和氢氧化钾 |
| D.理论上消除标况下的有害气体NH3 22.4 L,需消耗氢气3克 |
您最近一年使用:0次
9. 合成氨工业的反应原理为N2(g)+ 3H2(g) 2NH3(g) ΔH= a kJ/mol,1molN2和3molH2在不同条件下发生反应,测得平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
2NH3(g) ΔH= a kJ/mol,1molN2和3molH2在不同条件下发生反应,测得平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是

 2NH3(g) ΔH= a kJ/mol,1molN2和3molH2在不同条件下发生反应,测得平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
2NH3(g) ΔH= a kJ/mol,1molN2和3molH2在不同条件下发生反应,测得平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
| A.p1>p2 |
| B.a>0 |
| C.在q点时,固定容器的体积,并投入N2、H2各0.25 mol,NH3 1.5 mol后,反应速率变为v(正)>v(逆) |
| D.q点N2的转化率为50 % |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
10. 已知电离常数:HCNKa=5×10-10,H2CO3Ka1=4.3×10-7,Ka2=5.6×10-11。下列有关离子方程式的书写正确的是
A.向NaH2PO4(aq)中滴入少量的Ba(OH)2(aq):3Ba2++6OH—+3H2PO = Ba3(PO4)2↓+PO = Ba3(PO4)2↓+PO +6H2O +6H2O |
B.在含有1mol明矾[KAl(SO4)2•12H2O]的水溶液中,加入1mol的Ba(OH)2:2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
C.向浓度为1.25mol/L的NaOH(aq) 1 L中通入22.4 L(标准状况测定)的CO2气体:2OH-+ CO2 = CO + H2O + H2O |
D.向KCN(aq)中通入少量的CO2气体:CO2+H2O+2CN-= 2HCN+CO |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
11. 常温下,下列各组离子在指定溶液中一定不能大量共存的是
A.在无色透明的溶液中,Na+、K+、Cl-、S2-、SO |
B.在水电离出的c(H+)=10-13mol / L的溶液中,Na+、SiO 、NO 、NO 、MnO 、MnO |
C.在滴入酚酞呈无色的溶液中,Ca2+、Al3+、NO 、F- 、F- |
D.含有NH 的溶液中,Ag+、Cu2+、Fe3+、NO 的溶液中,Ag+、Cu2+、Fe3+、NO |
【知识点】 限定条件下的离子共存解读 影响水电离的因素解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
13. 下列实验过程、现象、结论均正确的是
| A.将研细的Ba(OH)2•8H2O粉末与NH4Cl置于小烧杯内,充分搅拌,用手触摸烧杯外壁,会感到烧杯变冷,用镊子取一张干燥的红色石蕊试纸放在烧杯口的上方,没有看到试纸有颜色变化,说明氨气在水中的溶解性很大,生成的氨气全部溶解在了生成的水中 |
| B.实验室用NH4Cl固体和熟石灰混合加热,并用装有CaCl2的球形干燥管干燥氨气,用向下排空气法进行收集,实验完毕,在集气瓶中未检测到氨气,说明装置漏气 |
| C.实验室将浸透石蜡油的石棉,放在试管的底部,并在试管的中下部放上碎瓷片后,对碎瓷片加强热,将生成的气体通入KMnO4(aq,H+)中,可见KMnO4(aq,H+)褪色,说明石蜡油分解,有不饱和烃生成 |
D.在盛Na2CO3与NaHCO3固体各1 g的两支试管中,分别滴入几滴水,振荡,用手摸试管底部,前者明显放热,而后者无明显感觉,因为CO 的水解程度要比HCO 的水解程度要比HCO 的大,所以,本实验即可证明水解过程是一个放热过程 的大,所以,本实验即可证明水解过程是一个放热过程 |
您最近一年使用:0次
单选题
|
困难(0.15)
名校
14. 常温下,向10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH•H2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;已知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O]=l.60×l0-4。下列说法正确的是( )


| A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L |
| B.从a到c的过程中,水的电离程度最大的是b点 |
| C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-) |
| D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NH•H2O] |
您最近一年使用:0次
2020-06-05更新
|
1418次组卷
|
3卷引用:广西南宁市2020届高三第二次适应性测试理科综合化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
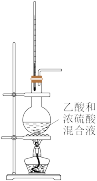
15. 甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。某兴趣小组利用下列装置来制取甲烷,并探究其与氯气反应的条件。
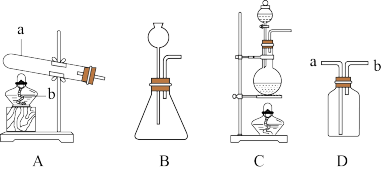
(1)甲烷与氯气的制备:
①制备甲烷是通过下列反应来完成的:CH3COONa+NaOH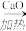 Na2CO3+CH4↑
Na2CO3+CH4↑
则应选用的实验装置是____ 和_____ 。收集甲烷时,甲烷应从____ 端通入。
②制取氯气时,实验室里只有下列药品:a.稀盐酸 b.浓硫酸 c.硝酸钾 d.漂粉精 e.食盐。制取Cl2最好选用的药品是______________ ,制备时的化学反应方程式为________ 。
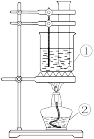
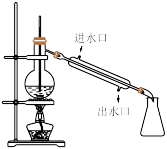
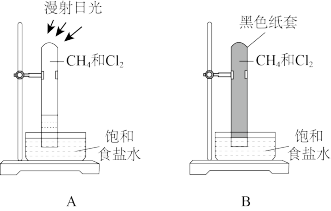
(2)取2支硬质大试管,通过排饱和食盐水法先后各收集半试管甲烷和半试管氯气。分别用铁架台固定好,按如图的A、B装置进行实验,片刻观察后,补充并完成下列实验报告的内容。

(1)甲烷与氯气的制备:
①制备甲烷是通过下列反应来完成的:CH3COONa+NaOH
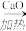 Na2CO3+CH4↑
Na2CO3+CH4↑则应选用的实验装置是
②制取氯气时,实验室里只有下列药品:a.稀盐酸 b.浓硫酸 c.硝酸钾 d.漂粉精 e.食盐。制取Cl2最好选用的药品是
(2)取2支硬质大试管,通过排饱和食盐水法先后各收集半试管甲烷和半试管氯气。分别用铁架台固定好,按如图的A、B装置进行实验,片刻观察后,补充并完成下列实验报告的内容。

| 原理 | 用饱和食盐水收集Cl2的原因是 |
| 实验现象 | A装置:①试管内气体黄绿色逐渐变浅 |
| ②试管内壁有油滴状液体出现 | |
| ③试管内液面上升 | |
| ④试管内液面上方有 | |
| ⑤水槽底部有 | |
| B装置: | |
| 结论 | CH4与Cl2在 |
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
16. 卤块的主要成分是MgCl2,此外还有Fe3+、Fe2+和Mn2+等离子,若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
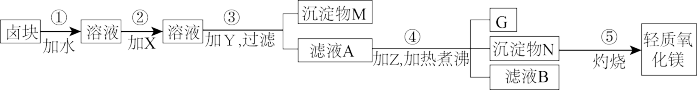
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
制备过程中所能使用的原料价格表如下:
(1)为加快卤块的溶解速率,得到澄清溶液,步骤①中应采取的措施是__________ 。
(2)在步骤②中加入试剂X,最佳的选择是________ 。反应的离子方程式________ 。反应中若就地取材,采用通入__________ 替代原料,则更加经济实用。
(3)步骤③中加入的试剂应是____________ ,将溶液的pH调至________ ,沉淀物M主要成分的化学式是______________ 。
(4)步骤④中加入的试剂Z应是_______ 。反应的离子方程式________ 。
(5)根据上表数据计算,当0.010 mol/L MgCl2溶液中,Mg2+完全沉淀时的c(Mg2+)=____ mol / L。
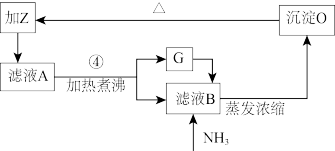
(6)若将工艺流程进行改进,则第④步产生的G和滤液B可循环利用。形成沉淀O的化学方程式是_______________ 。
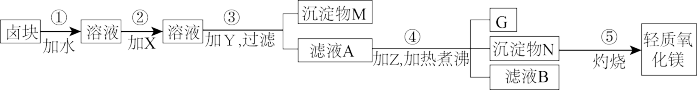
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
| 金属离子 | Mg2+ | Mn2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c = 0.010 mol / L)的pH | 9.6 | 8.3 | 2.7 | 7.6 |
| 沉淀完全时的pH | 11.1 | 9.8 | 3.7 | 9.6 |
制备过程中所能使用的原料价格表如下:
| 物质 | 漂液 (含25.2%NaClO) | 双氧水 (含30%H2O2) | 烧碱 (含98%NaOH) | 纯碱 (含99.5%Na2CO3) |
| 价格(元•吨-1) | 450 | 2400 |
(1)为加快卤块的溶解速率,得到澄清溶液,步骤①中应采取的措施是
(2)在步骤②中加入试剂X,最佳的选择是
(3)步骤③中加入的试剂应是
(4)步骤④中加入的试剂Z应是
(5)根据上表数据计算,当0.010 mol/L MgCl2溶液中,Mg2+完全沉淀时的c(Mg2+)=
(6)若将工艺流程进行改进,则第④步产生的G和滤液B可循环利用。形成沉淀O的化学方程式是

您最近一年使用:0次
17. 燃料与空气的组成比例不合理时,在高温下就可能在烟道气中排放出氮的氧化物和氮的氢化物,对环境造成污染,因此,需要通过转化以达到排放标准。
(1)已知T℃时,有如下反应:
反应Ⅰ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH= -1804 kJ•mol-1
5N2(g)+6H2O(g) ΔH= -1804 kJ•mol-1
反应Ⅱ:N2(g)+2O2(g) 2NO2(g) ΔH= +67.8 kJ•mol-1
2NO2(g) ΔH= +67.8 kJ•mol-1
反应Ⅲ:2NO(g)+O2(g) 2NO2(g) ΔH= -116.2 kJ•mol-1
2NO2(g) ΔH= -116.2 kJ•mol-1
试写出T℃时,NH3与1mol NO2反应生成不污染环境物质的热反应方程式:______ 。
(2)T℃时,向2 L密闭容器中加入一定量的NO2、NO、O2,此时容器内的压强为1.22 atm。发生(1)中的反应Ⅲ,不同时间测得各物质的部分浓度(mol•L-1)如下表所示:
①反应前20 min的平均反应速率v(NO)=______________ mol/(L•min)
②在该温度下,此反应的平衡常数Kp =_____________ atm-1(Kp是平衡分压代替平衡浓度计算所得的平衡常数,分压=总压× 物质的量分数)
③若温度不变,平衡后将容器扩大为4 L,达到新平衡后,则c(O2)_____________ (填范围数值)。
(3)依据(1)的反应原理,将含有氮的氧化物和氮的氢化物的烟气,按一定流速通过脱硝装置反应后,测得出口NOx的浓度与温度的关系如图,试分析脱硝的适宜温度是________ 。
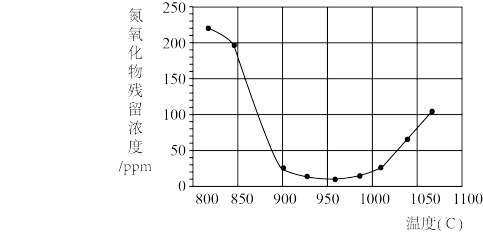
A.<850℃ B.900 ~ 1000℃ C.>1050℃
(4)以连二硫酸盐(S2O )为还原剂脱出烟气中的NOx,消除其对环境的污染,并通过电解进行再生,如图所示。
)为还原剂脱出烟气中的NOx,消除其对环境的污染,并通过电解进行再生,如图所示。
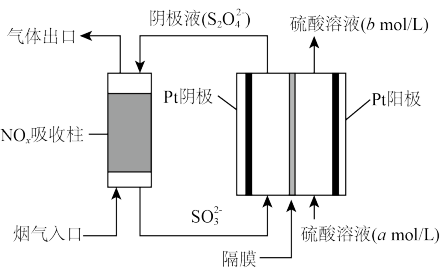
①NOx吸收柱内发生反应的离子方程式为__________ 。
②阴极的电极反应式为_____________ 。阳极的硫酸溶液a_________ b(填“>” “=” 或 “<”)
(1)已知T℃时,有如下反应:
反应Ⅰ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH= -1804 kJ•mol-1
5N2(g)+6H2O(g) ΔH= -1804 kJ•mol-1反应Ⅱ:N2(g)+2O2(g)
 2NO2(g) ΔH= +67.8 kJ•mol-1
2NO2(g) ΔH= +67.8 kJ•mol-1反应Ⅲ:2NO(g)+O2(g)
 2NO2(g) ΔH= -116.2 kJ•mol-1
2NO2(g) ΔH= -116.2 kJ•mol-1试写出T℃时,NH3与1mol NO2反应生成不污染环境物质的热反应方程式:
(2)T℃时,向2 L密闭容器中加入一定量的NO2、NO、O2,此时容器内的压强为1.22 atm。发生(1)中的反应Ⅲ,不同时间测得各物质的部分浓度(mol•L-1)如下表所示:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| NO | a | 0.12 | 0.08 | d | 0.06 |
| O2 | 0.31 | 0.27 | 0.25 | 0.24 | e |
| NO2 | 0.10 | b | 0.22 | 0.24 | f |
①反应前20 min的平均反应速率v(NO)=
②在该温度下,此反应的平衡常数Kp =
③若温度不变,平衡后将容器扩大为4 L,达到新平衡后,则c(O2)
(3)依据(1)的反应原理,将含有氮的氧化物和氮的氢化物的烟气,按一定流速通过脱硝装置反应后,测得出口NOx的浓度与温度的关系如图,试分析脱硝的适宜温度是

A.<850℃ B.900 ~ 1000℃ C.>1050℃
(4)以连二硫酸盐(S2O
 )为还原剂脱出烟气中的NOx,消除其对环境的污染,并通过电解进行再生,如图所示。
)为还原剂脱出烟气中的NOx,消除其对环境的污染,并通过电解进行再生,如图所示。
①NOx吸收柱内发生反应的离子方程式为
②阴极的电极反应式为
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
名校
解题方法
18. 已知有机物能发生以下转化:

A的产量通常用来衡量一个国家的石油化工水平。在一定条件下,A可以发生自身加成反应,形成高分子化合物E。
(1)A分子中碳原子的杂化轨道类型是_______ 。E的链节的结构简式是_____________ 。
(2)写出检验C的一个反应的化学方程式____________ 。反应的类型是_________ 。
(3)为测定反应①中A的产率,取0.25 mol A 与100 mL H2O充分反应后得B溶液。取B溶液25.00 mL,用标准KMnO4溶液(浓度为0.100 0 mol/L)进行滴定。
①滴定时盛装KMnO4溶液应选用的仪器是_________ 。滴定终点的现象是_________ 。
②重复滴定四次,每次消耗KMnO4标准溶液的体积如下表所示。
计算A转化为B的产率为_________
③若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定的结果____________ 。(填“偏高”、“偏低”或“不变”)
(4)若完全燃烧0.1 mol某烃,燃烧产物依次通过浓H2SO4、浓碱液,实验结束后,称得浓H2SO4增重10.8克,浓碱液增重39.6克。若该烃的核磁共振氢谱图上只有两组峰,其峰面积之比为3:1,则它与KMnO4(H+,aq)充分反应后,生成的有机物名称是_________ 。

A的产量通常用来衡量一个国家的石油化工水平。在一定条件下,A可以发生自身加成反应,形成高分子化合物E。
(1)A分子中碳原子的杂化轨道类型是
(2)写出检验C的一个反应的化学方程式
(3)为测定反应①中A的产率,取0.25 mol A 与100 mL H2O充分反应后得B溶液。取B溶液25.00 mL,用标准KMnO4溶液(浓度为0.100 0 mol/L)进行滴定。
①滴定时盛装KMnO4溶液应选用的仪器是
②重复滴定四次,每次消耗KMnO4标准溶液的体积如下表所示。
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 11.90 | 12.65 | 12.50 | 12.35 |
③若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定的结果
(4)若完全燃烧0.1 mol某烃,燃烧产物依次通过浓H2SO4、浓碱液,实验结束后,称得浓H2SO4增重10.8克,浓碱液增重39.6克。若该烃的核磁共振氢谱图上只有两组峰,其峰面积之比为3:1,则它与KMnO4(H+,aq)充分反应后,生成的有机物名称是
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、初中衔接知识点、化学反应原理
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硫与氧气的反应 油脂在碱性条件下水解 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 阿伏加德罗常数的求算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.65 | 物质的分离、提纯 常见气体的制备与收集 有机物的检验 | |
| 4 | 0.65 | 酚类的化学性质 含酯基有机物水解消耗NaOH的量的计算 | |
| 5 | 0.85 | 同系物 同分异构体书写 苯的同系物 苯的同系物的硝化反应 | |
| 6 | 0.4 | 元素周期律的应用 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 | |
| 7 | 0.65 | 浓硫酸的吸水性 钠与盐溶液的反应 铜绿 化学实验 | |
| 8 | 0.65 | 电解池电解基本判断 电解原理的应用实验 利用电子守恒法进行多池串联相关计算 | |
| 9 | 0.4 | 化学平衡的移动及其影响因素 化学平衡的有关计算 转化率的相关计算及判断 | |
| 10 | 0.4 | 离子反应的发生及书写 明矾与氢氧化钡溶液反应的离子方程式 弱电解质的电离平衡常数 | |
| 11 | 0.65 | 限定条件下的离子共存 影响水电离的因素 | |
| 12 | 0.65 | 乙烯制备的机理及装置 苯的硝化实验探究 石油分馏实验 | |
| 13 | 0.65 | 氨的碱性 盐类水解的原理 石蜡油分解实验 | |
| 14 | 0.15 | 酸碱中和滴定指示剂选择 弱电解质的电离平衡 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 15 | 0.65 | 氯气的实验室制法 甲烷取代反应实验探究 综合实验设计与评价 | 实验探究题 |
| 16 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 17 | 0.4 | 化学反应原理综合考查 盖斯定律的应用 化学平衡常数的影响因素及应用 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 18 | 0.65 | 有机物的推断 常用仪器及使用 有机物的检验 探究物质组成或测量物质的含量 | 有机推断题 |