11-12高一·江西·阶段练习
名校
解题方法
1 .  、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为
 、
、 和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中
和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中 、
、 和CO的体积比为
和CO的体积比为| A.22∶1∶14 | B.29∶8∶13 | C.26∶8∶57 | D.13∶8∶29 |
您最近一年使用:0次
2022-01-03更新
|
2583次组卷
|
34卷引用:2015-2016学年辽宁省辽阳一中高一上学期9月教学质检化学试卷
2015-2016学年辽宁省辽阳一中高一上学期9月教学质检化学试卷辽宁省葫芦岛市第一中学2017-2018学年高一上学期第一次月考化学试题辽宁省葫芦岛市第一高级中学2017-2018学年高一上学期第一次月考化学试题(已下线)2012-2013学年江西省四校高一零班第一次月考化学试卷(已下线)2013-2014黑龙江省哈六中高二下学期期末考试化学试卷(已下线)2014-2015学年河南省方城县第一高级中学高一10月月考化学试卷2015-2016学年浙江省余姚中学高一上10月月考化学试卷2015-2016学年内蒙古集宁一中高一上第一次月考化学试卷2016-2017学年河北省廊坊一中高一上学期第一次月考化学试卷2016-2017学年河北省定州中学高二(承智班)下学期开学考试化学试卷江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】湖南省衡阳县第四中学2019届高三第一次月考(9月)化学试题【全国百强校】四川省成都市双流区棠湖中学2018-2019学年高一上学期第一次月考化学试题【校级联考】湖北省重点高中协作体2018-2019学年高一上学期期中联考化学试题吉林省白城市通榆县第一中学2019-2020学年高一上学期第一次月考化学试题河南省鲁山县第一高级中学2019-2020学年高一9月月考化学试卷试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高一上学期期中考试化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高一上学期第一次阶段考试化学试题吉林省长春市东北师大附中净月校区2019-2020学年高一12月月考化学试题湖南省株洲市攸县三中2019-2020学年高一上学期第一次月考化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用(提升练)(已下线)【南昌新东方】江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题贵州省毕节市威宁第四中学2022届高三第一次月考化学试题黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题福建省厦门外国语学校石狮分校2021-2022学年高一上学期第一次月考化学试题福建省师范大学附属中学2021–2022学年高一上学期期中考试化学试题上海市进才中学2022-2023学年高一上学期期中考试化学试题上海师范大学附属中学2022-2023学年高一上学期期中考试化学试题四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题
12-13高三下·江苏扬州·阶段练习
名校
解题方法
2 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是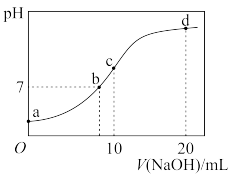
A.点 所示溶液中: 所示溶液中: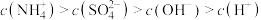 |
B.点 所示溶液中: 所示溶液中: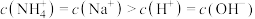 |
C.点 所示溶液中: 所示溶液中: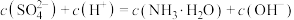 |
D.点 以后的溶液中可能出现: 以后的溶液中可能出现: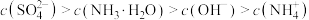 |
您最近一年使用:0次
2021-12-29更新
|
1232次组卷
|
23卷引用:辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题
辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题(已下线)2013届江苏省扬州市高三下学期5月考前适应性考试化学试卷2017届江苏省南通市高三高考全真模拟(四)化学 试卷2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综合化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(四)江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题新疆2018届高三第一次适应性检测(一模)理科综合化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷黑龙江省安达市第七中学2019-2020学年高二下学期第一次网络检测化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题上海交通大学附属中学2021届高三下学期3月月考化学试题天津市耀华中学2021届高三年级第二次模拟考试化学试题吉林油田高级中学2021-2022学年高二上学期期中考试化学试题江西省九江市第一中学2021-2022学年高二上学期期末化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题
3 . Ⅰ.由三种元素组成的固体化合物A,按如下流程进行实验。已知气体C为纯净物,气体E能使湿润的红色石蕊试纸变蓝。
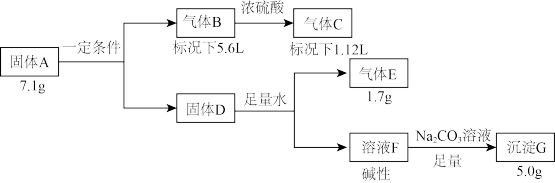
请回答:
(1)组成A的三种元素是N和____ (填元素符号),A的化学式是____ 。
(2)固体D与足量水反应的离子方程式是____ 。
(3)将气体E通入SCl2的热溶液中可制得S4N4,同时生成一种常见的盐和一种淡黄色单质,该反应的化学方程式是____ 。
II. 某实验小组用下图装置进行铜和浓硫酸反应的实验。
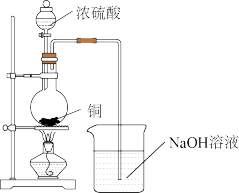
请回答:
(1)上述装置有一处不合理,请从安全角度提出改进方案____ 。
(2)实验中观察到有白色固体生成,请设计实验方案检验该白色固体成分____ 。

请回答:
(1)组成A的三种元素是N和
(2)固体D与足量水反应的离子方程式是
(3)将气体E通入SCl2的热溶液中可制得S4N4,同时生成一种常见的盐和一种淡黄色单质,该反应的化学方程式是
II. 某实验小组用下图装置进行铜和浓硫酸反应的实验。

请回答:
(1)上述装置有一处不合理,请从安全角度提出改进方案
(2)实验中观察到有白色固体生成,请设计实验方案检验该白色固体成分
您最近一年使用:0次
2020-12-09更新
|
1464次组卷
|
4卷引用:辽宁省部分中学2019-2020高一下学期期末考试化学试题
辽宁省部分中学2019-2020高一下学期期末考试化学试题浙江省嘉兴市2021届高三12月教学测试化学试题(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)2022年浙江省6月高考真题变式题26-31
名校
解题方法
4 . 有一化合物X,其水溶液为浅绿色,有如图所示的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀 ,H和M反应可放出大量的热。(电解装置中用石墨做电极)下列说法正确的是( )
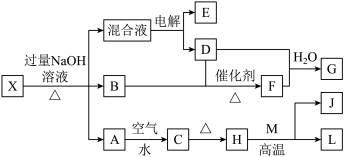

| A.生成G的反应中,生成1molG转移1mol电子 |
| B.此转化关系中只有一个置换反应 |
| C.“混合液”电解一段时间后pH不变 |
| D.检验X中是否存在Cl-,所用试剂为HNO3酸化的AgNO3 |
您最近一年使用:0次
2020-12-02更新
|
1933次组卷
|
3卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
10-11高二上·吉林·期中
名校
解题方法
5 . 在容积恒定的密闭容器中充入2molA和1molB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
 xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )
xC(g),达到平衡后,C的体积分数为w;若维持容器的容积和温度不变,按起始物质的量:0.6molA(g)、0.3molB(g)和1.4molC(g)充入容器,达到平衡后,C的体积分数仍为w,则x的值为( )| A.只能为2 | B.只能为3 |
| C.可能为2,也可能为3 | D.无法确定 |
您最近一年使用:0次
2020-10-31更新
|
1298次组卷
|
19卷引用:辽宁省辽阳2017-2018学年高二化学上学期期末考试题
辽宁省辽阳2017-2018学年高二化学上学期期末考试题(已下线)2010年吉林省吉林一中高二上学期期中考试化学试题(已下线)2015届甘肃省肃南县第一中学高三10月月考理综化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷山西省太原市山西大学附属中学2015-2016学年高二下2月模块诊断化学卷2016-2017学年河南省漯河中学高二上第一次月考化学卷河北省张家口市第一中学2016-2017学年高一(衔接班)下学期期末考试(理)化学试题2018版化学(苏教版)高考总复习专题七增分补课7--化学平衡分析中的虚拟过程--化学反应的方向和限度河南省安阳县第一高级中学2017-2018学年高二上学期第三次月考化学试卷河北省安平中学2019届高三上学期第五次月考化学试题【市级联考】福建省三明市2019届高三上学期期末质量检测化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题黑龙江省绥化市明水县第一中学2020-2021学年高二上学期第一次月考化学试题北京二中2020-2021学年高二上学期10月月考化学试题河北省邢台市第二中学2021届高三上学期第四次月考化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题河南省延津第一高级中学2021-2022学年高二上学期第五次考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题
6 . 高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
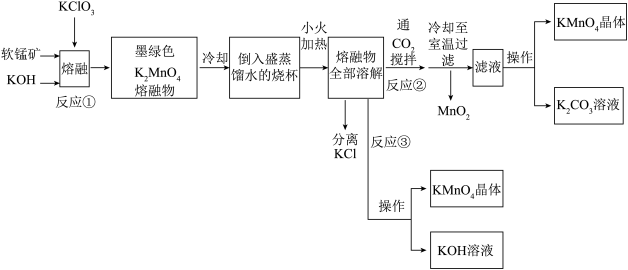
已知:
请回答
(1)反应①的化学方程式为_________________________________ ;
加热软锰矿、KClO3和KOH固体,不采用瓷坩埚而选用铁坩埚的理由是______________ ;
(2)反应②中氧化产物与还原产物的物质的量之比为__________________ ;
上述流程中可以循环利用的物质是__________________________ ;
(3)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是________________________________________________________ ;
(4)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤除去Fe(OH)3 Al(OH)3;③…
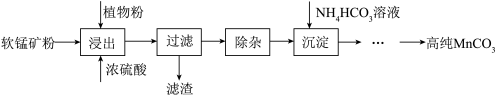
①软锰矿预先粉碎的目的是_____________________________________ ;
②试剂X可以是__________ ;(填出一种即可)
③浸出时加入植物粉的作用是_________________________________ ;
④写出“沉淀”过程中产生碳酸锰的离子方程式___________________________ 。

已知:
| 温度 | 溶解度/g | ||
| K2CO3 | KHCO3 | KMnO4 | |
| 20℃ | 111 | 33.7 | 6.38 |
(1)反应①的化学方程式为
加热软锰矿、KClO3和KOH固体,不采用瓷坩埚而选用铁坩埚的理由是
(2)反应②中氧化产物与还原产物的物质的量之比为
上述流程中可以循环利用的物质是
(3)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是
(4)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤除去Fe(OH)3 Al(OH)3;③…

①软锰矿预先粉碎的目的是
②试剂X可以是
③浸出时加入植物粉的作用是
④写出“沉淀”过程中产生碳酸锰的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2020-08-18更新
|
3400次组卷
|
7卷引用:浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)
浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题
解题方法
8 . 氨及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为N2+3H2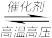 2NH3,2NH3+CO2
2NH3,2NH3+CO2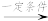 H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:
(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表示式为_______ ,Zn位于元素周期表的______ 区。
(2)C、N、O三种元素第一电离能从大到小的顺序是___________ >
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是________ ,原因是___________ 。
(4)尿素分子中,C原子杂化轨道类型是______ , N原子杂化轨道类型是______ ,σ键与π键数目之比为_______ 。
(5)氮化硼(BN)是-种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼如图(a)和六方氮化硼(b),前者类似于金刚石,后者与石墨相似。

①X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体N与B的原子半径之和为______ pm。(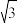 =1.732)
=1.732)
②已知六方氮化硼同层中B、N原子距离为a cm,密度为d g/cm3,则层与层之间距离的计算表达式为__________ 。
 2NH3,2NH3+CO2
2NH3,2NH3+CO2 H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表示式为
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是
(4)尿素分子中,C原子杂化轨道类型是
(5)氮化硼(BN)是-种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼如图(a)和六方氮化硼(b),前者类似于金刚石,后者与石墨相似。

①X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体N与B的原子半径之和为
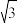 =1.732)
=1.732)②已知六方氮化硼同层中B、N原子距离为a cm,密度为d g/cm3,则层与层之间距离的计算表达式为
您最近一年使用:0次
名校
9 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.45mol |
| D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2020-07-22更新
|
3036次组卷
|
11卷引用:辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题
辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题辽宁省大连市2019-2020学年高一下学期期末考试化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高一9月月考化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题山西省实验中学2020-2021学年高一下学期第一次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期4月月考化学试题云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
解题方法
10 . 某实验室模拟以粗盐(含杂质Mg2+、Ca2+、K+和 )为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
)为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
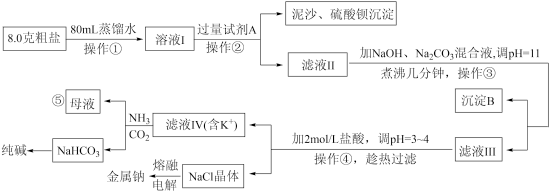
(1)过量试剂A是_________________________ 溶液。(填名称)
(2)图为KCI和NaCl的溶解度曲线,连续操作④是_____________________________ 。

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是_______________ (用必要的化学用语和文字说明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka=3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是___________________________________ 。
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7mol/L,则镁元素最终沉淀物是_________________ 。
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl NC13十3H2↑。
NC13十3H2↑。
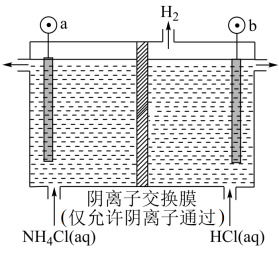
阳极反应式是___________________________________ 。
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是_____________ 。
 )为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
)为原料进行生产并综合利用的某过程如下图所示。已知:Ksp[Mg(OH)2]=5.6×10-12;Ksp[CaMg(CO3)2]<< Ksp[Mg(OH)2]。
(1)过量试剂A是
(2)图为KCI和NaCl的溶解度曲线,连续操作④是

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka=3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7mol/L,则镁元素最终沉淀物是
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl
 NC13十3H2↑。
NC13十3H2↑。
阳极反应式是
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是
您最近一年使用:0次
2020-05-27更新
|
1024次组卷
|
2卷引用:辽宁协作校2019-2020学年度下学期高三第二次模拟考试化学试卷



