名校
1 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用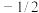 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为______ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角______ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是____________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为______ , 的空间构型是
的空间构型是______ ;已知尿素分子所有原子在同一平面且含有与苯类似的“大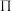 键”,其“大
键”,其“大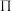 键”可表示为
键”可表示为______ (用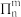 表示,其中
表示,其中 表示参与形成大
表示参与形成大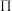 键的原子数,
键的原子数, 表示形成大
表示形成大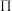 键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是
键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是______ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为______ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为______  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用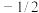 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是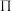 键”,其“大
键”,其“大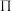 键”可表示为
键”可表示为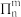 表示,其中
表示,其中 表示参与形成大
表示参与形成大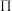 键的原子数,
键的原子数, 表示形成大
表示形成大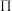 键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是
键的电子数);尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
您最近一年使用:0次
2 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: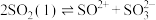 。
。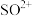 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和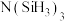 的结构如图所示,
的结构如图所示,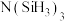 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
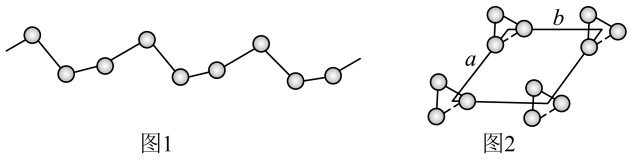
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、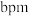 、
、 (其中
(其中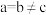 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则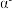 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
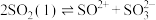 。
。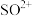 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和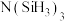 的结构如图所示,
的结构如图所示,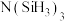 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是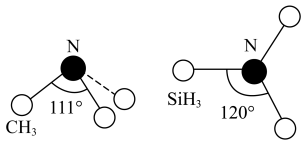
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、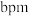 、
、 (其中
(其中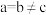 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
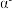 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
3 . 研究二氧化碳的转化与减排具有重要的社会意义。用 还原
还原 的反应过程如下:
的反应过程如下:
①
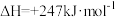
②

回答下列问题:
(1)

_______ 。
(2)同时提高 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是_______ 。
(3)在密闭容器中分别充入0.1mol 与0.3mol
与0.3mol 。
。
①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为____ ;该条件下,反应②的平衡常数为_____ 。
②在150℃时,改变密闭容器的体积,测得 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是____ ; 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是_______ 。 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能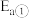
_______ 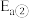 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②随温度升高, 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是_______ 。
 还原
还原 的反应过程如下:
的反应过程如下:①

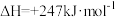
②


回答下列问题:
(1)


(2)同时提高
 与
与 的平衡转化率和速率的措施是
的平衡转化率和速率的措施是(3)在密闭容器中分别充入0.1mol
 与0.3mol
与0.3mol 。
。①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出
 和
和 均为0.05mol。10min内
均为0.05mol。10min内 的平均反应速率为
的平均反应速率为②在150℃时,改变密闭容器的体积,测得
 和
和 平衡转化率随压强变化如图所示。
平衡转化率随压强变化如图所示。 平衡转化率随压强增大而减小的主要原因是
平衡转化率随压强增大而减小的主要原因是 后
后 平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是
平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是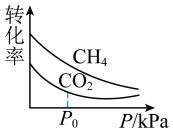
 和
和 ,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
,加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下: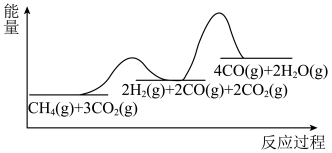
 体积分数很低,主要原因是活化能
体积分数很低,主要原因是活化能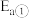
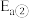 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②随温度升高,
 的体积分数变化趋势为先增后减小,其可能原因是
的体积分数变化趋势为先增后减小,其可能原因是
您最近一年使用:0次
4 . 实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ. 制备
制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是_______ 。
(2)控制温度在40~50℃的原因是_______ 。
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为_______ 。
Ⅱ.无水 制备
制备
已知 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。
(4)按图装置进行实验。锥形瓶中生成无水 的总化学方程式为
的总化学方程式为_______ ;仪器A的作用是_______ 。
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用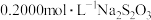 溶液滴定(
溶液滴定(
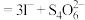 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。
①所制产品的纯度为_______ (以无水 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);
②所制产品中可能含有 杂质,检验
杂质,检验 的试剂为
的试剂为_______ (填化学式)溶液;产生 的原因可能是
的原因可能是_______ 。
Ⅰ.
 制备
制备①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)用NaOH溶液洗涤废铁屑的目的是
(2)控制温度在40~50℃的原因是
(3)滴加10%双氧水时,滴加速率过快会产生气泡。该气体为
Ⅱ.无水
 制备
制备已知
 熔点―156℃,沸点77℃,易水解生成
熔点―156℃,沸点77℃,易水解生成 和HCl。
和HCl。(4)按图装置进行实验。锥形瓶中生成无水
 的总化学方程式为
的总化学方程式为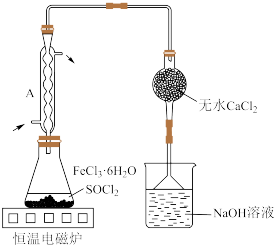
(5)称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用
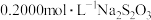 溶液滴定(
溶液滴定(
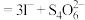 ),经三次平行实验,平均消耗
),经三次平行实验,平均消耗 溶液19.00ml。
溶液19.00ml。①所制产品的纯度为
 质量分数表示,保留三位有效数字);
质量分数表示,保留三位有效数字);②所制产品中可能含有
 杂质,检验
杂质,检验 的试剂为
的试剂为 的原因可能是
的原因可能是
您最近一年使用:0次
5 . 下图为常温Al(OH)3、Mn(OH)2、Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1),M为Al3+、Mn2+或Cu2+;c(M)≤10-5mol/L可认为M离子沉淀完全)。下列叙述正确的是
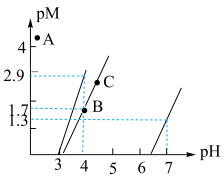
| A.常温下,Ksp[Al(OH)3]=10-22.3 |
| B.加适量CuCl2固体可使溶液由B点变到C点 |
C.若A点为含Al3+、Cu2+的混合溶液,则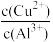 =10-0.7 =10-0.7 |
| D.浓度均为0.1mol/L的Cu2+和Mn2+可通过分步沉淀进行分离 |
您最近一年使用:0次
名校
解题方法
6 . 甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
反应Ⅱ:CO(g)+ H2O(g) CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
反应Ⅲ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
回答下列问题:
(1)ΔH2=___________ kJ·mol-1。
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随 变化的情况如图1所示。
变化的情况如图1所示。

①图中表示H2转化率、CH4产率变化的曲线分别是___________ 、___________ (填标号), A、C两点 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是___________ 。
②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=___________ [CH4的选择性=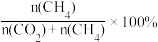 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=___________ (用分压表示,分压=总压×物质的量分数)。
(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值___________ (填“大”或者“小”)。若溶液pH已知,则钙离子的实际浓度为___________ mol/L[用含c(H+),Ksp,Ka2的式子表达]。
已知涉及的反应如下:
反应Ⅰ:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1
CH4(g)+H2O(g) ΔH1= -206.2kJ·mol-1反应Ⅱ:CO(g)+ H2O(g)
 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2反应Ⅲ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1
CH4(g)+2H2O(g) ΔH3= -165 kJ·mol-1回答下列问题:
(1)ΔH2=
(2)在360°C时,在固定容积的容器中充入一定量的CO进行上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
 变化的情况如图1所示。
变化的情况如图1所示。
①图中表示H2转化率、CH4产率变化的曲线分别是
 的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是
的值相同,C点通过改变温度达到A点,则A、B、C三点温度由大到小的顺序是②一定温度下,向恒容容器内充入3mol H2和1molCO,初始压强为4p0,发生上述3个反应,达到平衡时CO的分压为p1,CO2的分压为p2,则CH4的选择性=
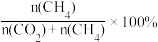 ,用p0,p1,p2表示,下同],反应Ⅱ的Kp=
,用p0,p1,p2表示,下同],反应Ⅱ的Kp=(3)已知常温下,CaCO3的溶度积常数为Ksp,H2CO3的二级电离常数为Ka2。CaCO3溶于水除了沉淀溶解平衡,还存在碳酸根的水解(忽略二级水解)。则常温下,CaCO3的实际溶解度比理论值
您最近一年使用:0次
2023·全国·模拟预测
解题方法
7 . 甲酸是基本有机化工原料之一,广泛应用于农药、皮革、染料、医药和橡胶等工业。在较高温度或有催化剂存在下,它会分解成CO和 或
或 和
和 。
。
反应Ⅰ: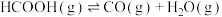

反应Ⅱ: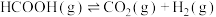
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的 =
=___________  。
。
(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。
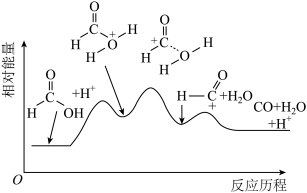
该反应的催化剂为___________ ,该反应历程中速率最慢步骤的化学方程式为___________ 。
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体, 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
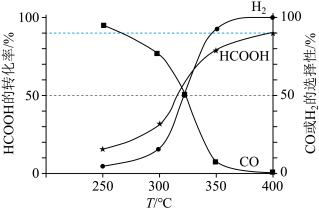
①400℃时,反应Ⅱ的平衡常数 =
=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×体积分数;结果保留小数点后1位)。
②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:___________ 。
(4)已知:25℃时, 的电离平衡常数
的电离平衡常数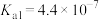 ,
,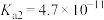 ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。
①将100mL 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL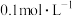 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:___________ 。
②25℃时,当溶液中 时,溶液中
时,溶液中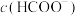 =
=___________  。
。
 或
或 和
和 。
。反应Ⅰ:
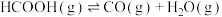

反应Ⅱ:
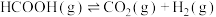
(1)已知工业上甲酸的能量关系转换会涉及以下反应:




则反应Ⅱ的
 =
= 。
。(2)一定温度下,甲酸在某催化剂作用下分解的能量变化过程如图所示。

该反应的催化剂为
(3)恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,
 分解成CO和
分解成CO和 或
或 和
和 。平衡体系中CO或
。平衡体系中CO或 的选择性和HCOOH的转化率随温度变化曲线如图所示。
的选择性和HCOOH的转化率随温度变化曲线如图所示。
①400℃时,反应Ⅱ的平衡常数
 =
=②图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降的可能原因:
(4)已知:25℃时,
 的电离平衡常数
的电离平衡常数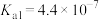 ,
,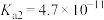 ,HCOOH的电离平衡常数
,HCOOH的电离平衡常数 。
。①将100mL
 的HCOOH溶液加入50mL
的HCOOH溶液加入50mL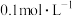 的碳酸钠溶液中,写出相应反应的离子方程式:
的碳酸钠溶液中,写出相应反应的离子方程式:②25℃时,当溶液中
 时,溶液中
时,溶液中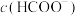 =
= 。
。
您最近一年使用:0次
真题
名校
8 . 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。

测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为___________ (填化学式)。
(3)实验①和②的结果表明_________ ;实验①中0~t1时间段反应速率v(Cr3+)=___ mol·L-1·min-1
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:_____________ ;
假设三:_____________ ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O72-的浓度可用仪器测定。)_____________
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。

| 实验编号 | 初始pH | 废水样品体积mL | 草酸溶液体积mL | 蒸馏水体积mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
(2)上述反应后草酸被氧化为
(3)实验①和②的结果表明
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:
假设三:
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O72-的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
您最近一年使用:0次
2019-01-30更新
|
2497次组卷
|
15卷引用:2014届高考化学二轮复习四川配套训练 第13讲实验方案的设计练习卷
(已下线)2014届高考化学二轮复习四川配套训练 第13讲实验方案的设计练习卷(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)第22讲 化学反应速率 (精讲)——2021年高考化学一轮复习讲练测(已下线)易错23 化学实验评价与探究-备战2021年高考化学一轮复习易错题(已下线)第18讲 化学反应速率(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)2013年全国普通高等学校招生统一考试理科综合能力测试化学(安徽卷)2015-2016学年广东汕头金山中学高二上10月月考化学卷安徽省铜陵市第一中学2017-2018学年高二10月月考化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 高考帮人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 方法帮内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题浙江省宁波市北仑中学2020-2021学年高一上学期期中考试化学(1班)试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度广东省大联考2021-2022学年高一下学期期中检测化学试题
9 . 某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。
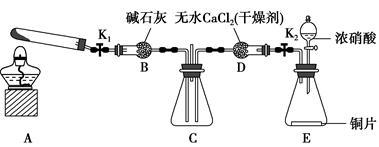
(1)E装置中制取NO2的化学反应方程式是______ 。
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是______ 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______ 。
(4)此实验装置中一个明显的缺陷是______ 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:______ 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。
①装置的合理连接顺序是(某些装置可以重复使用)______ 。
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。

(1)E装置中制取NO2的化学反应方程式是
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
(4)此实验装置中一个明显的缺陷是
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。

①装置的合理连接顺序是(某些装置可以重复使用)
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为
您最近一年使用:0次
10 . 固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是______ 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明______ 。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是______ ;关闭k,用酒精灯加热时,正确操作是先______ ,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______ 是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______ (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是______ 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
您最近一年使用:0次



